
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:选择题
工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化:2SO2+O2  2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是 ( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是 ( )
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,SO2不可能100%转化为SO3
C.为了提高SO2的转化率,应适当提高O2的浓度
D.达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三第六次适应性考试理综化学试卷(解析版) 题型:选择题
熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站。某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图。下列说法正确的是
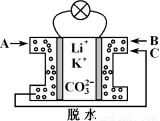
A.Li+、K+移向左侧电极
B.外电路中电子由右侧电极移向左侧电极
C.通入1 mol气体A时,左侧电极上生成5 mol CO2
D.相同条件下通入气体B与气体C的体积比为2∶1
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第八次模拟理综化学试卷(解析版) 题型:选择题
化学与人类社会的生产、生活有着密切联系。下列叙述中正确的是( )
A. “歼﹣20”飞机上大量使用的碳纤维是一种新型的有机高分子材料
B.“神舟十号”宇宙飞船返回舱外表面主要是导电导热良好的新型金属材料钛合金
C.“天宫一号”是中国第一个空间实验室,其太阳能电池板的主要材料是硅
D.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第二次模拟理综化学试卷(解析版) 题型:选择题
在常温下,用0.1000 mol/L的盐酸滴定25 mL 0.1000 mol/LNa2CO3 溶液,所得滴定曲线如下图所示。下列微粒浓度间的关系不正确的是
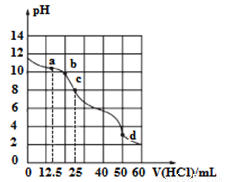
A.a点:c( HCO3-)>c(Cl-)>c(CO32-)
B.b点:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(CO32-)+c(OH-)
C.c点:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
D.d点:c(Cl-)=c(Na+)
查看答案和解析>>
科目:高中化学 来源:2016届江西南昌二中、临川一中等高三4月联考二理综化学试卷(解析版) 题型:实验题
银氨溶液可用于检测CO气体,实验室研究的装置如图:
| 已知:①银氨溶液的化学式为: Ag(NH3)2OH ②反应结束后试管C底部有黑色 沉淀生成, ③分离出上层清液和底部黑色 固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 性。
(2)装置A中软管的作用是 。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是 。
②根据上述实验现象判断,上层清液中产物成分为 (填化学式)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应 。
②若该反应中消耗3.3 g羟氨,理论上可得银的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2016届江西南昌二中、临川一中等高三4月联考二理综化学试卷(解析版) 题型:选择题
有机物X、Y、M(已知M为乙酸)的转化关系为:淀粉→X→Y 乙酸乙酯,下列说法不正确的是
乙酸乙酯,下列说法不正确的是
A.X可用新制的氢氧化铜悬浊液检验
B.实验室由Y和M制取乙酸乙酯时可用饱和Na2CO3溶液来提纯
C.乙酸乙酯的同分异构体中含有“-COO-”结构的还有3种
D.Y分子中含有3种不同环境的氢,峰面积比为3:2:1
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三第五次适应性考试理综化学试卷(解析版) 题型:实验题
钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
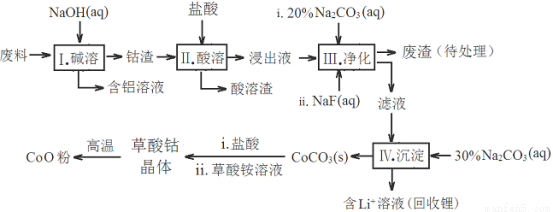
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是____________________________。
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式_________________________
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过__________。废渣中的成分有______________________。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是___________。
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二化合物,该化合物中钴元素的质量分数为73.44%。此过程发生反应的化学方程式是_________________。
(6)某锂离子电池的总反应为C+LiCoO2 LixC+Li1-xCoO2,LixC中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为______________。
LixC+Li1-xCoO2,LixC中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com