

 (R为烃基),则有机物A的结构
(R为烃基),则有机物A的结构 ,试写出苧烯的同分异构体(用
,试写出苧烯的同分异构体(用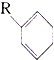 表示)与
表示)与 反应的化学方程式:
反应的化学方程式: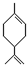 含有2个碳碳双键,可与氢气发生加成反应;
含有2个碳碳双键,可与氢气发生加成反应; 含有2个碳碳双键,可与Br2发生加成反应,生成两种有机物;
含有2个碳碳双键,可与Br2发生加成反应,生成两种有机物; 与
与 发生加成反应生成新的环状结构.
发生加成反应生成新的环状结构. 含有2个碳碳双键,可与氢气发生加成反应,则1mol苧烯最多可以跟2molH2发生反应,故答案为:2;
含有2个碳碳双键,可与氢气发生加成反应,则1mol苧烯最多可以跟2molH2发生反应,故答案为:2; 含有2个碳碳双键,可与Br2发生加成反应,生成两种不同的结构,则所得产物的可能的结构为
含有2个碳碳双键,可与Br2发生加成反应,生成两种不同的结构,则所得产物的可能的结构为 ,
, ;
;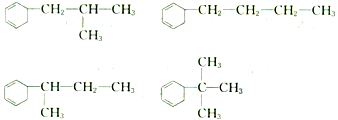 ,其中环的侧链上一氯代物有4种,则侧链烃基上有4种环境的氢,则其的结构简式为
,其中环的侧链上一氯代物有4种,则侧链烃基上有4种环境的氢,则其的结构简式为 ;
;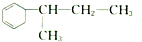 ;
; 与
与 发生加成反应生成新的环状结构,其反应方程式
发生加成反应生成新的环状结构,其反应方程式 ,
, .
.


科目:高中化学 来源: 题型:
| A、高铁酸钾与水反应时,水发生还原反应 |
| B、湿法中每生成1mol Na2FeO4共转移3mol电子 |
| C、干法中每生成1mol Na2FeO4 共转移5mol电子 |
| D、K2FeO4处理水时,不仅能杀菌消毒,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中消耗3molP时,转移电子的物质的量为15mol |
| B、发令时产生的白烟只有KCl固体颗粒 |
| C、“火药”中的红磷可用白磷代替 |
| D、反应中红磷是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HN3水溶液中粒子浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-) |
| B、若HN3比HCN酸性强,则相同体积相同物质的量浓度的NaN3与NaCN溶液中,离子总数NaN3比NaCN少 |
| C、NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) |
| D、HN3与NH3作用生成的叠氮酸铵是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ、在下列化合物中:H2O、Na2O、NaCl、KOH、CO2、NH4Cl、Na2O2、H 2O2、CH4、N2,请填空:
Ⅰ、在下列化合物中:H2O、Na2O、NaCl、KOH、CO2、NH4Cl、Na2O2、H 2O2、CH4、N2,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
1 1 |
3 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、12gC所具有的能量一定高于28gCO所具有的能量 |
| B、56gCO和32gO2所具有的总能量一定高于88gCO2所具有的总能量 |
| C、12gC和32gO2所具有的总能量一定高于44gCO2所具有的总能量 |
| D、将相同质量的碳燃烧,生成CO2比生成CO放出的热量多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com