
| 2 |
| 2×(2-0) |


科目:高中化学 来源: 题型:
| A、元素周期表中一共有7个周期和18个族 |
| B、金属元素的原子最外层电子数一定都小于4 |
| C、质量数相同的两种原子,一定不互为同位素 |
| D、主族元素X的原子序数为a,所在周期的元素种数为b,则与x同族的下一周期的元素Y的原于序数一定为a+b |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,其水溶液 pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍.Z与钠元素形成的化合物Q的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M.
X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,其水溶液 pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍.Z与钠元素形成的化合物Q的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
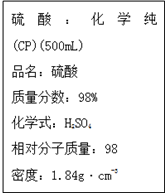 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将金粉和铜粉混合 |
| B、将牛奶加入水中混合 |
| C、蒸发食盐水制取食盐晶体 |
| D、用漏斗、滤纸过滤除去水中的泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分离沙子和食盐水溶液 |
| B、从氯化钠和硝酸钾的混合物中提纯硝酸钾 |
| C、分离溶于水中的氯化钠 |
| D、将O2和CO2混合气体通过NaOH溶液除去CO2气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com