
【题目】如图是一套制取并验证氯气部分化学性质的实验装置。
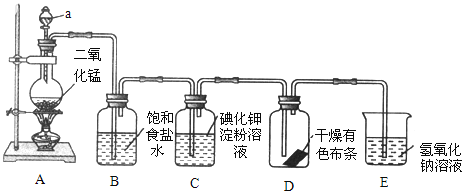
回答下列问题:
(1)装置 A 中,仪器 a 的名称叫_____,该仪器中盛放的试剂为_____,装置 B的作用是_____。
(2)装置 A 中发生反应的化学方程式是_____。
(3)当 Cl2 持续通过时,装置 D 中干燥的有色布条能否褪色?为什么?_____,____。
(4)若要证明干燥的 Cl2 无漂白性,可在装置 D 前添加一个装有_____的洗气瓶。
(5)装置 E 的作用是_____,该反应的离子方程式为_____。
【答案】分液漏斗 浓盐酸 吸收 HCl MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2 ↑ 能褪色 因为 Cl2 与带出的 H2O(g)反应生成 HClO,使有色布条褪色 浓 H2SO4 除去多余的 Cl2 Cl2+2OH=Cl+ClO+H2O
MnCl2 + 2H2O + Cl2 ↑ 能褪色 因为 Cl2 与带出的 H2O(g)反应生成 HClO,使有色布条褪色 浓 H2SO4 除去多余的 Cl2 Cl2+2OH=Cl+ClO+H2O
【解析】
本题实验目的是制取Cl2和验证Cl2部分化学性质,从装置图上看,A装置是实验室制Cl2的“固+液![]() 气”装置,分液漏斗a中盛装浓盐酸,产生的Cl2中混合HCl气体, Cl2难溶于食盐水,而HCl极易溶于水,所以饱和食盐水的作用就是除去Cl2中的HCl气体,;Cl2能置换I2,淀粉溶液遇I2变蓝;Cl2有毒,必须有尾气吸收装置,E中NaOH溶液能很好地吸收Cl2:2NaOH+Cl2=NaCl+NaClO+H2O,由此分析解答。
气”装置,分液漏斗a中盛装浓盐酸,产生的Cl2中混合HCl气体, Cl2难溶于食盐水,而HCl极易溶于水,所以饱和食盐水的作用就是除去Cl2中的HCl气体,;Cl2能置换I2,淀粉溶液遇I2变蓝;Cl2有毒,必须有尾气吸收装置,E中NaOH溶液能很好地吸收Cl2:2NaOH+Cl2=NaCl+NaClO+H2O,由此分析解答。
(1)仪器a的名称叫分液漏斗,该仪器中盛放浓盐酸,为实验中添加浓盐酸,控制反应速率。因Cl2在饱和食盐水中溶解度很小,而HCl气体极易溶液于水,所以装置B吸收HCl,以除去Cl2的混有的HCl气体。
(2)浓盐酸与MnO2在加热条件下反应制取Cl2,其化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(3)当Cl2通过B、C溶液时会带有水蒸气,D中干燥的有色布条遇到潮湿的Cl2时有反应Cl2+H2O=HCl+HClO,HClO具有漂白性,所以有色布条褪色。
(4)若要证明干燥的Cl2无漂白性,就必须将Cl2中的水蒸气除去,而题目要求是通过洗气瓶,因此应选用液态干燥剂浓硫酸,所以在装置 D 前添加一个装有浓硫酸的洗气瓶。
(5)Cl2有毒,不能排放到大气中,多余的Cl2必须吸收,因Cl2易与NaOH溶液反应:2NaOH+Cl2=NaCl+NaClO+H2O,所以装置E的作用是除去多余的Cl2;该反应的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列有关生活中的化学知识运用合理的是
A. 明矾可用于自来水消毒
B. 食品包装袋内的小袋铁粉主要起干燥作用
C. 工业上可用电解AlCl3溶液的方法制备金属Al
D. 工业上可用氯化铵溶液除去金属表面的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________;K、F、Zn的电负性从大到小的顺序为___________。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________。
(3)OF2分子的几何构型为___________,中心原子的杂化类型为___________。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为___________个。
②晶胞中紧邻的两个F-间的距离为_______________________(列出算式即可)nm。
③该晶体的密度为___________(列出算式即可,用NA表示阿伏加德罗常数的数值)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫的叙述中,正确的是 ( )
A.硫只以化合态存在于自然界中B.硫是一种黄色、能溶于水的晶体
C.硫在空气中燃烧生成二氧化硫D.硫在过量纯氧中燃烧生成三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.氢氧燃料电池可把化学能转化为电能
C.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
D.锌锰干电池中,锌电极是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以稀硫酸为电解质溶液的铜﹣﹣锌原电池中,已知其电极反应分别为锌片:Zn﹣2e﹣=Zn2+;铜片:2H++2e﹣=H2↑.下列判断正确的是( )
A.溶液的酸性逐渐增强
B.铜片逐渐溶解
C.溶液中H+向锌片作定向移动
D.锌片是负极并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。下列说法错误的是
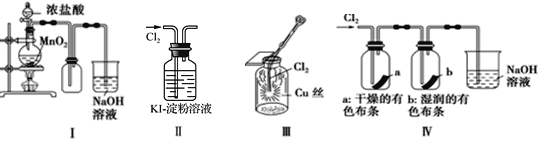
A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B. Ⅱ图中:溶液变蓝
C. Ⅲ图中:生成棕黄色的烟
D. Ⅳ图中:干燥的有色布条不褪色,湿润的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各小题。
Ⅰ.按要求书写:
(1)甲基的电子式________。
(2)﹣C3H7结构简式:__________、________。
(3)![]() 的系统命名为__________。
的系统命名为__________。
(4)相对分子质量为72且沸点最低的烷烃的结构简式__________。
(5)分子式为C5H12O的饱和一元醇有多种,不能发生催化氧化的醇分子结构简式_____。
Ⅱ.按要求书写下列化学方程式
(1)2-甲基-1,3-丁二烯与等物质的量的溴在60℃时发生1,4-加成的反应:__________。
(2)乙醛与银氨溶液水浴加热:________。
(3)CH3CHClCOOCH2CH3与氢氧化钠水溶液共热:________。
(4)乙二醇和乙二酸脱水成环酯:________。
Ⅲ.有一种有机物X的键线式如图所示。
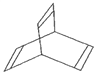
(1)X的分子式为________。
(2)有机物Y是X的同分异构体,且属于芳香族化合物,则Y的结构简式是______。
(3)Y在一定条件下可生成高分子化合物,该反应的化学方程式是______________。
(4)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有____种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com