
在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
⑴该温度下,水的离子积常数Kw= 。
⑵在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH= ,此时该溶液中由水电离的c(OH-)= 。
⑶该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
⑷该温度下,pH=3的硫酸溶液和pH=9的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7);pH=3的醋酸溶液和pH=9的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7)。
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
29.(18分)在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)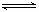 2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
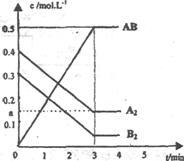 (1)该反应进行到__________min时达到平衡,用AB表示的平均反应速率为: mol/(L.min)(用分数表示)。
(1)该反应进行到__________min时达到平衡,用AB表示的平均反应速率为: mol/(L.min)(用分数表示)。
(2)图中对应的a的数值是_________,该反应的化学平衡常数Kc=__________(保留分数)。温度升高Kc值___________(填“增大”、“减少”或“不变”)。
(3)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线。
(4)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol。则反应向 反应方向进行(填“正”或“逆”)。判断依据是 。反应达到平衡后,各物质的体积分数与原平衡相比___________(填序号)
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关pH变化的判断中,错误的是
A.随着温度的升高,醋酸溶液的pH减小
B.随着温度的升高,纯水的pH增大
C.新制氯水经光照一段时间后,pH减小
D.氢氧化钠溶液久置于空气中,pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
通常状况下,下列物质中① 硫酸钡 ② 醋酸 ③ 氯化氢 ④ 三氧化硫 ⑤ 氯气 ⑥ 碳酸氢钠 ⑦ 铜 ⑧ 硫酸溶液 ⑨氢氧化钾 ⑩乙醇(下列各空填序号)
⑴属于强电解质的是:
⑵属于弱电解质的是:
⑶能导电的是:
⑷属于非电解质的是:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B.由C(石墨)=C(金刚石) ΔH= +11.9 kJ/mol,可知金刚石比石墨稳定
C.水力(水能)按不同的分类可看成可再生能源和一级能源
D.可表示氢气燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解质溶液的叙述正确的是
A. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
B. pH相同的盐酸和醋酸溶液,加水稀释100倍后两溶液pH仍相同
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.25 ℃,将pH = 5的盐酸稀释1000倍后,溶液的pH=8
查看答案和解析>>
科目:高中化学 来源: 题型:
为了完成教材上的“中和热的测定”这个实验
(1)实验桌上有烧杯(大、小两个)、泡沫塑料、泡沫塑料板(中心有两个小孔)、环形玻璃搅拌棒,0.50mol·L-1盐酸、0.55mol·L—1NaOH溶液,尚缺少的实验用品是 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?答: (填“能”或“否”)。其原因是 。
(3)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g·cm—3,生成溶液的比热容c=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式: 。
(4)如果用50mL的0.60mol·L-1盐酸与50mL 的0.55mol·L—1NaOH溶液进行反应。若热量无损失,与上述实验相比,所求中和热 (填“偏大、偏小、相等”),简述理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备硝基苯的方法是将苯与浓硫酸和浓硝酸的混合液加热到55~60 ℃反应,已知苯与硝基苯的基本物理性质如下表所示:
| 熔点 | 沸点 | 状态 | |
| 苯 | 5.51 ℃ | 80.1 ℃ | 液体 |
| 硝基苯 | 5.7 ℃ | 210.9 ℃ | 液体 |
(1)要配制浓硫酸和浓硝酸的混合酸的注意事项是___________________ ________________________________________________。
(2)分离硝基苯和水的混合物的方法是 ;分离硝基苯和苯的方法是__________________________________________________。
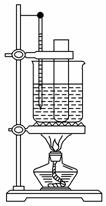
(3)某同学用如图装置制取硝基苯:
①用水浴加热的优点是__________________________________________;
②指出该装置的两处缺陷____________________________________________________;
___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com