
 ��16.8g̼��������11.7g�������ƹ����Ϻ����ܱ������м��ȳ�ַ�Ӧ���ų��������ʺ���ȴ���õ��������X��
��16.8g̼��������11.7g�������ƹ����Ϻ����ܱ������м��ȳ�ַ�Ӧ���ų��������ʺ���ȴ���õ��������X������ ��16.8g̼��������11.7g�������ƹ����Ϻ�n��NaHCO3��=$\frac{16.8g}{84g/mol}$=0.2mol��n��Na2O2��=$\frac{11.7g}{78/mol}$=0.15mol
��1��̼�����Ʒֽ����ɶ�����̼��ˮ��̼���ƣ�������̼��ˮ�������Ʒ�Ӧ��������̼�������Ʒ�Ӧ����̼���ƺ�������ˮ�����������Ʒ�Ӧ�����������ƺ�������
��2����2NaHCO3 $\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+CO2��+H2O����֪2mol̼�����Ʒֽ�����1moNa2CO3��1molCO2��1molH2O��Ȼ��������Ʒֱ���ˮ�Ͷ�����̼��Ӧ��ȷ�����Ĺ�������ʣ�
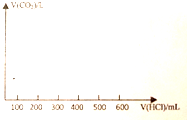
��3�����ݷ�����֪����X�к���0.1molNaOH��0.1mol+0.1mol=0.2mol��Na2CO3����μ���1mol/L��ϡ���������ٲ�������Ϊֹ������������Ϊ������̼���壬̼Ԫ���غ�õ�������̼���ʵ���Ϊ0.2mol���������V=nVm���㣬����X�е������ᷢ���ķ�ӦΪ���������Ʒ�Ӧ����̼���Ʒ�Ӧ����̼�����ƣ���̼�����Ʒ�Ӧ���ɶ�����̼���壬�������ʵ����ֱ������ҪHCl��������㻭��������̼�������ɵ�ͼ��仯��
��� �⣺��1��̼�����Ʒֽ����ɶ�����̼��ˮ��̼���ƣ�2NaHCO3 $\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+CO2��+H2O��������̼��ˮ�������Ʒ�Ӧ��������̼�������Ʒ�Ӧ����̼���ƺ�������2Na2O2+2CO2=2Na2CO3+O2��ˮ�����������Ʒ�Ӧ�����������ƺ�������2Na2O2+2H2O=4NaOH+O2����
�ʴ�Ϊ��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����
��2����2NaHCO3 $\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+CO2��+H2O����֪0.2mol̼�����Ʒֽ�����0.1moNa2CO3��0.1molCO2��0.1molH2O�����ᷢ����Ӧ��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2�����ڶ�����̼���������Ʒ�Ӧ����̼���ƣ�������Ϊ�����������������̼��Ӧ������ˮ��Ӧ��Na2O2ֻ��0.15mol��ǡ�ú�CO2��Ӧ����0.1molNa2CO3��O2��ʣ���������0.05mol��ˮ������Ӧ����ˮ����0.05mol������0.1molNaOH�������ų���ֻʣ��NaOH��Na2CO3��ѡC��
�ʴ�Ϊ��C��
��3�����ݷ�����֪����X�к���0.1molNaOH��0.1mol+0.1mol=0.2mol��Na2CO3����μ���1mol/L��ϡ���������ٲ�������Ϊֹ������������Ϊ������̼���壬̼������̼Ԫ���غ�õ�������̼���ʵ���Ϊ0.2mol����״�������=0.2mol��22.4L/mol=4.48L������X�к���0.1molNaOH��0.1mol+0.1mol=0.2mol��Na2CO3����μ���1mol/L��ϡ���������ٲ�������Ϊֹ��������Ӧ�Ļ�ѧ����ʽΪ��
NaOH+HCl=NaCl+H2O��
0.1mol 0.1mol
Na2CO3+HCl=NaCl+NaHCO3��
0.2mol 0.2mol 0.2mol
NaHCO3+HCl=NaCl+CO2��+H2O��
0.2mol 0.2mol 0.2mol
����Ũ��Ϊ1mol/L�����ʵ�������ֵ��Ϊ�������ʼ���������ɣ����������������������0.1mol�����Ϊ100ml����̼���Ʒ�Ӧ����̼����������0.2mol���������Ϊ200ml����̼�����Ʒ�Ӧ����HCl���ʵ���Ϊ0.2mol�������������Ϊ200ml��̼������ȫ�����ɶ�����̼���壬����������ٱ仯��������ͼ��Ϊ��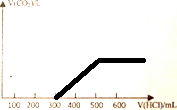
�ʴ�Ϊ��4.48L�� ��
��
���� ���⿼���ƵĻ��������Ҫ���ʣ���ѧ��Ӧ���̺ͻ�ѧ����ʽ������ϵ�����������ɵ�ͼ��仯��Ϊ��Ƶ���㣬������Ԫ�ػ�����֪ʶ���ۺ���������õĿ��飬��ȷ���������������̼����ˮ�ķ�Ӧ����Ӧ���Ⱥ�˳���ǽ����Ĺؼ����Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X��Y��Z�ķ��Ӹ�����Ϊ3��1��2 | |
| B�� | X������������Z������������� | |
| C�� | ���������ܶȲ��ٸı� | |
| D�� | ��λʱ��������3n mol X��ͬʱ����n mol Y |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���ʱ����Ͻ������� | |
| B�� | ���ʱ������ΧpH���� | |
| C�� | �ŵ�ʱ������Ӧ��LaNi5H6+6OH--6e-�TLaNi5+6H2O | |
| D�� | �ŵ�ʱÿת��6mol���ӣ���6moLNiO��OH������ԭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
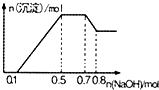 ij��Һ�п��ܺ���H+��NH4+��Mg2+��Al3+��Fe3+��CO32-��SO42-��Cl-�еļ��֣�������Һ�м���NaOH��Һ��������ɫ�������Ҳ����ij��������������ʵ���֮��Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ�������
ij��Һ�п��ܺ���H+��NH4+��Mg2+��Al3+��Fe3+��CO32-��SO42-��Cl-�еļ��֣�������Һ�м���NaOH��Һ��������ɫ�������Ҳ����ij��������������ʵ���֮��Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ��Һ�е�������ֻ��H+��Mg2+��Al3+ | |
| B�� | ��ȷ����Һ���Ƿ���CO32-��SO42-��Cl- | |
| C�� | ��Һ��n��NH4+��=0.2mol | |
| D�� | n��H+����n��Al3+����n��Mg2+��=1��1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ζ����� | ����Һ���/mL | Na2S2O3��Һ���/mL | |
| �ζ�ǰ������mL�� | �ζ��������mL�� | ||
| ��һ�� | 25.00 | 0.50 | 20.40 |
| �ڶ��� | 25.00 | 4.00 | 24.10 |
| ������ | 25.00 | 4.20 | 26.70 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
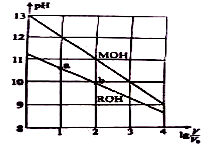 Ũ�Ⱦ�Ϊ0.10mol/L�������ΪV0��MOH��ROH��Һ���ֱ��ˮϡ�������V��pH��lg $\frac{V}{{V}_{0}}$�ı仯��ͼ��ʾ����������������ǣ�������
Ũ�Ⱦ�Ϊ0.10mol/L�������ΪV0��MOH��ROH��Һ���ֱ��ˮϡ�������V��pH��lg $\frac{V}{{V}_{0}}$�ı仯��ͼ��ʾ����������������ǣ�������| A�� | MOH �ĵ���̶���lg $\frac{V}{{V}_{0}}$����������� | |
| B�� | ROH �ĵ���̶ȣ�b�����a�� | |
| C�� | ������Һ����ϡ�ͣ������ǵ�c��OH-����� | |
| D�� | ��lg $\frac{V}{{V}_{0}}$=2 ʱ��������Һͬʱ�����¶ȣ���$\frac{c��{M}^{+}��}{c��{R}^{+}��}$��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ӷ�Ӧ��ʼ������ƽ������ʱ�䣺tA��tB | |
| B�� | ƽ��ʱI2��Ũ�ȣ�c��I2��A=c��I2��B | |
| C�� | ƽ��ʱ�������ڻ�������еİٷֺ�����A��������B���� | |
| D�� | ƽ��ʱHI�ķֽ��ʣ�aA=aB |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ϸ�Ӧ | B�� | �ֽⷴӦ | C�� | �û���Ӧ | D�� | ���ֽⷴӦ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com