
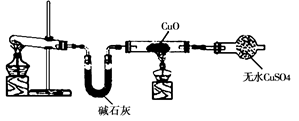
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入该单质a | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入该单质a | 无明显变化 |
| Ⅲ | 硫酸钠溶液中加入该单质a | 无明显变化 |
| Ⅳ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入该单质a | 有无色气泡;溶液变蓝 |
 CaCl2+2H2O+2NH3↑(2分)
CaCl2+2H2O+2NH3↑(2分) 3Cu+N2+3H2O (2分)
3Cu+N2+3H2O (2分)  CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。 3Cu+N2+3H2O。
3Cu+N2+3H2O。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:不详 题型:实验题
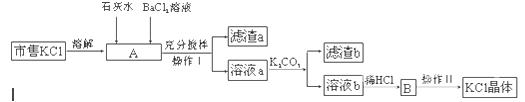
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
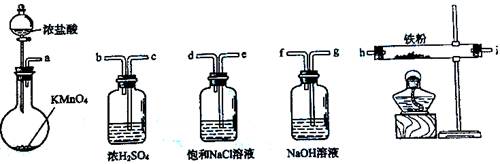
| A.a-b-c-d-e-e-f-g-h | B.a-e-d-c-b-h-i-g |
| C.a-d-e-c-b-h-i-g | D.a-c-b-d-e-h-i-f |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
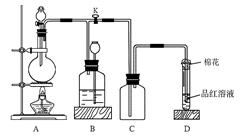
| A.水 | B.浓溴水 | C.酸性KMnO4溶液 | D.饱和NaHSO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
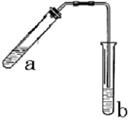
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸式滴定管不能装碱液,碱式滴定管不能装酸液或强氧化性溶液 |
| B.酸式滴定管用蒸馏水洗后,未用标准溶液润洗会引起测定结果偏高 |
| C.装待测液的锥形瓶应预先用待测液润洗 |
| D.在25.00 mL规格的滴定管中,当读数为15.00 mL时,实际体积大于10.00 mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com