
| A. | 2,3,3-三甲基丁烷 | B. | 2-乙基-2-丁烯 | ||
| C. | 4-羟基苯甲酸 | D. | 二乙醇(HOOC-COOH) |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号;如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.2,3,3一三甲基丁烷,取代基的编号之和不是最小,说明有机物的编号方向错误,正确命名应该为:2,2,3-三甲基丁烷,故A错误;
B.2-乙基-2-丁烯,烷烃的命名中不能出现2-乙基,说明选取的主链不是最长碳链,最长碳链应该含有6个C,正确命名应该为:3-甲基-2-戊烯,故B错误;
C.含氧衍生物中同时存在多种官能团时,先后顺序是:羧基(或酯基),醛基,羟基,4-羟基苯甲酸,说明含有羟基和羧基,且两者在对位上,此命名正确,故C正确;
D.HOOC-COOH含两个羧基,故为乙二酸,故D错误;
故选C.
点评 本题主要考查的是烷烃、烯烃以及乙基含氧衍生物的命名,本题难度不大,主要是掌握烷烃命名原则.


科目:高中化学 来源: 题型:选择题
| A. | 具有相同电子层数而又按原子序数递增顺序排列的横行称为周期 | |
| B. | 元素周期表共有14列元素:7个主族和7个副族 | |
| C. | 元素周期表的第一列元素称为第IA族,均为活泼的金属元素 | |
| D. | 元素周期表中第二周期第VIIA族元素的最高正价为+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
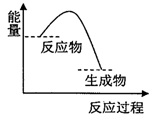
| A. | 该反应过程中,形成新化学键释放的总能量小于断裂旧化学键吸收的总能量 | |
| B. | 因为生成物的总能量低于反应物的总能量,所以该反应不需要加热即可进行 | |
| C. | 该图象可以表示碳酸钙受热分解的能量变化 | |
| D. | 该图象可以表示锌与稀硫酸反应的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 92g乙醇与足量的金属钠反应,生成氢气(H2)的分子数为NA | |
| C. | 标准状况下,22.4L已烷中碳碳键数目为5NA | |
| D. | 乙烯和甲醚的混合物共0.1mol,完全燃烧所消耗的氧分子数一定为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火燃烧时用砂子灭火 | |
| B. | 氯水保存在无色透明的试剂瓶中 | |
| C. | 漂白粉保存在烧杯中 | |
| D. | 大量氯气泄漏时用氢氧化钠溶液浸湿的软布蒙面并迅速离开现场 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 33% | C. | 50% | D. | 89% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
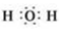 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工、农业生产和生活中有着重要作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com