
| m |
| M |
| V |
| Vm |
| N |
| Nm |
| m |
| n |
| 3g |
| 2g/mol |
| 3.36L |
| 22.4L/mol |
| 1.204×1024 |
| 6.02×1023mol-1 |
| 49g |
| 98g/mol |
| 46g |
| 46g/mol |
| 10g |
| 18g/mol |
| 8g |
| 32g |
| 11.25g |
| 0.125mol |


科目:高中化学 来源: 题型:
| A、原子半径:E>C |
| B、C、D的氧化物都不溶于氢氧化钠溶液 |
| C、氢氧化物的碱性:C>B |
| D、氢化物的稳定性:A>E |
查看答案和解析>>
科目:高中化学 来源: 题型:
 试回答:
试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
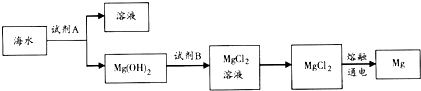
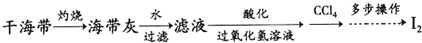
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有 关 信 息 |
| A | 元素主要化合价为-2,原子半径为0.074nm |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102nm,其单质为黄色晶体,可在A的单质中燃烧 |
| D | 最高价氧化物的水化物能按1:1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸钠溶液pH>7 |
| B、醋酸溶液能溶解碳酸钙 |
| C、0.1mol?L-1醋酸溶液pH=2.9 |
| D、pH=1的醋酸溶液稀释100倍后pH<3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+ Na+ NO3- Cl- |
| B、Fe2+ Na+ NO3- Cl- |
| C、SO42- S2O32- NH4+ Na+ |
| D、Mg2+ Na+ Br- AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在田间焚烧秸秆,增加草木灰肥料 |
| B、大量开采地下水,以满足生产、生活的需求 |
| C、用“复合石头纸”替代木浆纸,减少树木砍伐 |
| D、尽可能多的使用各种添加剂,改善食品的品质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com