

| A. | 金属钠与水的反应 | B. | 氢氧化钡晶体与氯化铵混合反应 | ||
| C. | 氧化钙与水的反应 | D. | 酒精燃烧 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
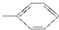 ⑤-CHO.
⑤-CHO.| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

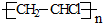 、I:
、I: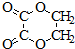 .
.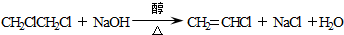 ;
;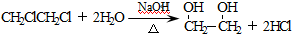 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=11的Na2SO3溶液中,水的电离c( H+)=1.0×10-11mol/L | |
| B. | PH=10的某BOH的碱溶液中加水稀释至100倍,稀释后的溶液中c( OH-)=1.0×10-6mol/L | |
| C. | PH=4的NaHC2O4溶液中存在:c( Na+)>c(HC2O4-)>c( H+)>c(C2O42-)>c( OH-) | |
| D. | PH=2的硝酸与PH=12的氨水等体积混合c( NO3-)>c( NH4+)>c( H+)>c( OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H2)保持不变 | |
| B. | 拆开2 mol H-I共价键,同时生成1 mol H-H共价键 | |
| C. | HI、H2、I2的浓度比为2:1:1 | |
| D. | 正反应和逆应都已停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应必然伴随着能量的变化 | |
| B. | 能量变化是化学反应的基本特征之一 | |
| C. | 化学变化的能量变化主要是由化学键的变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物的状态和物质的量无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO(NO2):通过装有水的洗气装置 | |
| B. | Cu粉(铁粉):加足量稀硝酸,过滤 | |
| C. | NH3(H2O):通过装有浓硫酸的洗气装置 | |
| D. | KCl(CaCl2):加适量Na2CO3溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com