
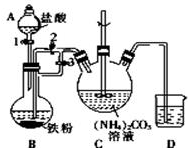
 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.
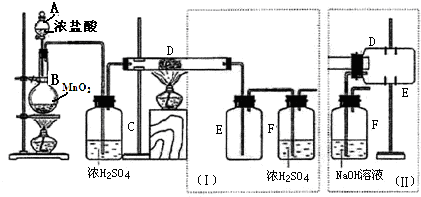
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.分析 (1)装置B中铁粉与稀盐酸反应生成氢气和氯化亚铁,据此判断反应现象;关闭活塞3、打开活塞2,产生的氢气使圆底烧瓶中压强增大,从而可将氯化亚铁溶液压人装置C;
(2)制备乳酸亚铁过程中加入Fe粉,可防止Fe2+离子被氧化,加入乳酸的目的是除去剩余铁粉;
(3)从溶液中获得晶体,应经过冷却结晶、过滤、洗涤、干燥等操作;
(4)先加入硫氰化钾溶液,溶液不变色,然后加入新制氯水,若溶液变为血红色则证明溶液中含有亚铁离子.
解答 解:(1)装置B中铁粉与稀盐酸反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,则观察到的现象为:铁粉逐渐溶解,液体中有气泡冒出、溶液变成浅绿色;先关闭活塞3、打开活塞2,铁与稀盐酸反应生成的氢气使圆底烧瓶中压强增大,从而将B中生成的FeCl2溶液压入装置C,
故答案为:有气泡冒出、溶液变成浅绿色;关闭活塞3,打开活塞2;
(2)制备乳酸亚铁过程中加入Fe粉,可防止Fe2+离子被氧化,过量的铁粉需要用乳酸除去,
故答案为:防止Fe2+被氧化;除去剩余铁粉;
(3)在75℃下搅拌使之充分反应制得乳酸亚铁,从热溶液中获得乳酸亚铁晶体,应经过冷却结晶、过滤、洗涤、干燥等操作,
故答案为:冷却结晶;过滤;
(4)证明乳酸亚铁中含Fe2+的方法为:取少量乳酸亚铁溶液于试管中,先滴加几滴KSCN溶液,溶液不变色,再滴加新制氯水,溶液变成血红色,
故答案为:取少量乳酸亚铁溶液于试管中,先滴加几滴KSCN溶液,溶液不变色,再滴加新制氯水,溶液变成血红色.
点评 本题考查了制备方案的设计与评价,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,注意掌握物质制备方案的设计与评价原则,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该条件下Z是气态 | B. | 平衡常数K=$\frac{c(Z)•c(W)}{c(X)•c(Y)}$ | ||
| C. | 增加Z平衡逆向移动 | D. | 上述过程中X的转化率变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| ①溶液的酸性 | 取少量0.5mol•L-1Fe(NO3)3于试管中,加入几滴3.0mol•L-1HNO3. | 现象:棕黄色溶液颜色变浅; 结论:酸性增强抑制Fe3+水解. |
| ②溶液的浓度 | 取10mL0.5mol•L-1 Fe(NO3)3于烧杯中,用pH计测得pH1.另取90mL蒸馏水加入烧杯,充分搅拌,再测得pH2. | 现象:pH2-pH1<1(或正确表达) 结论:稀释促进水解(或平衡右移) |
| ③溶液的温度 | 取少量0.5mol•L-1Fe(NO3)3于试管中,用酒精灯加热一段时间,观察溶液颜色 | 现象:加热后溶液颜色变深 结论:升高温度促进Fe3+水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -183 kJ•mol-1 | B. | +183 kJ•mol-1 | C. | -862 kJ•mol-1 | D. | +862 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com