
| A. | 1.0×l0-5 mo1•L-1盐酸的pH=5,将其稀释1000倍后pH=8 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 次氯酸钠溶液中离子浓度:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 由0.1 mo1•L-1一元酸HA溶液的pH=3,则其Ka=10-2 mo1•L-1 |
分析 A、酸溶液稀释后最多显中性;
B、c(H+)=10-pH;
C、根据物料守恒来分析;
D、在一元酸HA溶液中,c(H+)≈c(A-).
解答 解:A、酸溶液稀释后最多显中性,即稀释后pH最大为7,不可能为8,故A错误;
B、c(H+)=10-pH,故pH=4.5的番茄汁中c(H+)=10-4.5mol/L,pH=6.5的牛奶中c(H+)=10-6.5mol/L,即前者是后者的100倍,故B正确;
C、NaClO溶液中,由于ClO-是弱酸根,会部分水解,根据物料守恒可知:c(Na+)=c(ClO-)+c(HClO),故C错误;
D、在一元酸HA溶液中,c(H+)≈c(A-)=10-3mol/L,c(HA)=0.1mol/L-10-3mol/L=0.1mol/L,故Ka=$\frac{1{0}^{-3}mol/L×1{0}^{-3}mol/L}{0.1mol/L}$=10-5,故D错误.
故选B.
点评 本题考查了弱酸、弱碱的稀释、pH和电离平衡常数的有关计算,难度不大,注意盐类溶液中三个守恒的应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
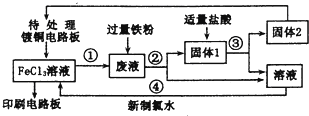
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M+N=P+Q | B. | M+2N=2P+Q | C. | 2M+N=2P+Q | D. | 2M+N=P+2Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 | |
| C. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| D. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
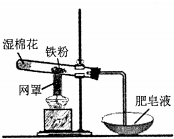
| A. | 该反应属于复分解反应 | |
| B. | 网罩的作用是集中火焰,提高温度 | |
| C. | 湿棉花的作用是给试管降温,防止炸裂 | |
| D. | 反应中水既不是氧化剂,也不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8KJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+285.8KJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6KJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
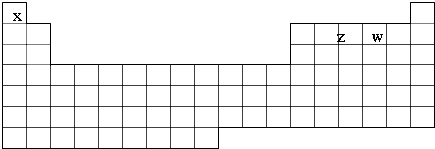
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com