
分析 (1)加入1molA和3molB,平衡时A的物质的量为a mol,则:
A(g)+3B(g)?3C(g)
起始量(mol):1 3 0
变化量(mol):1-a 3-3a 3-3a
平衡量(mol):a 3a 3-3a
进而计算C的体积分数;
(2)在相同的实验条件下,若在同一个容器中改为加入2molA和6molB,与(1)中A、B的物质的量之比均为2:1,恒温恒压下为等效平衡,平衡时同种物质的含量相等;
(3)改变起始投料量,平衡时C的体积分数相同,说明为等效平衡,恒温恒压下按化学计量数转化到方程式左边满足投料比相等,即满足n(A):n(B)=1:3.
解答 解:(1)加入1molA和3molB,平衡时A的物质的量为a mol,则:
A(g)+3B(g)?3C(g)
起始量(mol):1 3 0
变化量(mol):1-a 3-3a 3-3a
平衡量(mol):a 3a 3-3a
则平衡时C的体积分数为$\frac{(3-3a)mol}{(a+3a+3-3a)mol}$×100%=$\frac{3-3a}{3+a}$×100%,
故答案为:$\frac{3-3a}{3+a}$×100%;
(2)在相同的实验条件下,若在同一个容器中改为加入2molA和6molB,与(1)中A、B的物质的量之比均为2:1,恒温恒压下为等效平衡,平衡时同种物质的含量相等,即达到平衡后,C在混合气体中的体积百分含量不变,
故答案为:不变;
(3)改变起始投料量,平衡时C的体积分数相同,说明为等效平衡,恒温恒压下按化学计量数转化到方程式左边满足投料比相等,即满足n(A):n(B)=1:3,则:(n+$\frac{1}{3}$p)mol:(m+p)mol=1:3,整理可得m=3n,且p≥0,
故答案为:m=3n,且p≥0.
点评 本题考查化学平衡计算、等效平衡,关键理解等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化到一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化到一边,对应物质满足等比,2:恒温恒压,按化学计量数转化到一边,对应物质满足等比.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:解答题
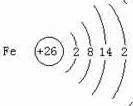 .与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.
.与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入稀盐酸可以促进氨水的电离,溶液的碱性增强 | |
| B. | 向溶液中加入等体积的pH=2盐酸后溶液呈酸性 | |
| C. | 由水电离产生的c(OH-)=10-12mol•L-1 | |
| D. | 向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
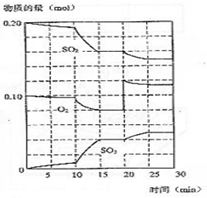 在一定条件下发生如下反应:2SO2(g)+O2 (g)?2SO3(g);△H<0
在一定条件下发生如下反应:2SO2(g)+O2 (g)?2SO3(g);△H<0查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的平均消耗速率为0.3mol(L•min) | |
| B. | C的平衡浓度为2mol/L | |
| C. | 平衡后,增大压强,平衡将向正方向移动 | |
| D. | 若单位时间内生成的B和C的物质的量之比为3:2,则体系处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
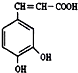 如图咖啡酸,存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
如图咖啡酸,存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.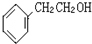 .
. 的一种同分异构体,A的苯环上有三个取代基,能发生银镜反应,苯环上的一氯代物有两种.写出A的一种结构简式:
的一种同分异构体,A的苯环上有三个取代基,能发生银镜反应,苯环上的一氯代物有两种.写出A的一种结构简式: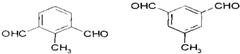 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠块沉在乙醇液面下面 | B. | 钠块熔成小球 | ||
| C. | 钠块在乙醇液面上游动 | D. | 钠块表面无气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com