
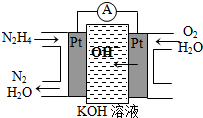
 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题分析 (1)燃料电池中负极发生氧化反应,正极发生还原反应;
(2)利用盖斯定律来计算2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)的反应热;
(3)在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,结合质量守恒定律来书写离子反应方程式;
解答 解:(1)燃料电池中负极发生氧化反应,正极发生还原反应,依据图中装置可知,肼在反应中失去电子生成氮气发生氧化反应,所以N2H4通入的一极应为电池的负极,通入氧气的一极为正极;
故答案为:负;
(2)由N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ•mol-1 ①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1 ②
2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1 ③
根据盖斯定律可知②×2-①-③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),
△H=(-534.0kJ•mol-1)×2-(-67.7kJ•mol-1)-(-52.7kJ•mol-1)=-947.6 kJ•mol-1,
即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ•mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ•mol-1;
(3)由在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,根据质量守恒定律可知两种盐为氯化钠和碳酸钠,该反应为CO(NH2)2+ClO-+2OH-=N2H4+CO32-+Cl-+H2O,
故答案为:CO(NH2)2+ClO-+2OH-=N2H4+CO32-+Cl-+H2O;
点评 本题考查了燃料电池电极的判断、热化学方程式的书写、离子方程式的书写,明确燃料电池工作原理及利用盖斯定律计算反应热的方法是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
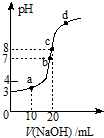 常温时,用0.10mol/L的NaOH溶液滴定20.00mL 0.10mol/L某 一元酸HA溶液所得滴定曲线如图.下列说法不正确的是( )
常温时,用0.10mol/L的NaOH溶液滴定20.00mL 0.10mol/L某 一元酸HA溶液所得滴定曲线如图.下列说法不正确的是( )| A. | a、b、c三点所示溶液导电能力最强的是c点对应的溶液 | |
| B. | 在c点溶液中:c(H+)+c(HA)=c(OH-) | |
| C. | 25℃,HA的电离平衡常数约为1.0×10-5 | |
| D. | a、b、c、d四点所示溶液中水的电离程度最大的是b点对应的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 | |
| B. | V1L④与V2L①混合,若混合后溶液pH=7,则V1<V2 | |
| C. | 分别加水稀释10倍后,四种溶液的pH①>②>④>③ | |
| D. | ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 数据编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY | |
| B. | 由表中数据可估算出Ka(HX)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-) | |
| D. | 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a、c两种元素只能组成化学式为ca3的化合物 | |
| B. | b、c、d分别与a形成的简单化合物,沸点由高到低依次为:d>c>b | |
| C. | 原子半径由大到小的顺序是 e>f>c>b>a | |
| D. | 元素的非金属性由强到弱的顺序是 d>c>f>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com