

| A、氢离子在负极得电子 |
| B、锌为负极,发生氧化反应 |
| C、铜为负极,铜片上有气泡产生 |
| D、电子从铜极流向锌极 |


科目:高中化学 来源: 题型:
| A、氢氟酸保存在密封的玻璃瓶中 |
| B、氢氧化钠溶液保存在带橡皮塞的试剂瓶中 |
| C、少量金属钠保存在煤油中 |
| D、硅酸钠保存在带橡皮塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠浮在水面,熔化成银色光亮的小球 |
| B、钠贮存在煤油中 |
| C、所得溶液的质量分数为2.25% |
| D、反应中转移0.1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若降低温度,可以减慢反应速率 |
| B、催化剂既能加快化学反应速率,又能提高SO2的转化率 |
| C、氧气足量时,SO2不能完全转化为SO3 |
| D、达到平衡时,SO2和SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某原子K层上只有一个电子 |
| B、某原子M层上电子数为L层上电子数的4倍 |
| C、某离子M层上和L层上的电子数均为K层的4倍 |
| D、某离子核电荷数与最外层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3- |
| B、SO32- |
| C、CO32- |
| D、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘与干冰分别受热变为气体 |
| B、硝酸铵与硝酸分别受热变为气体 |
| C、氯化钠与氯化氢分别溶解在水中 |
| D、二氧化硅晶体与冰分别受热熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
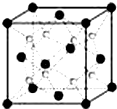 A~G是前四周期原子序数依次增大的七种元素.A、C的价电子层中未成对电子数都是2;D+与C的简单离子具有相同离子结构;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G为周期表第11列元素.回答下列问题:
A~G是前四周期原子序数依次增大的七种元素.A、C的价电子层中未成对电子数都是2;D+与C的简单离子具有相同离子结构;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G为周期表第11列元素.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com