
| A. | 某元素基态原最外层有3个未成对电子,最内层有2个电子,其元素符号为N | |
| B. | 某元素的负一价离子的电子层结构与氩相同,其基态原子价电子排布式为[Ne]3s23p5 | |
| C. | 某元素的正三价离子的3d能级为半充满,其基态原子排布式为[Ar]3d64s2 | |
| D. | 某元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的电子排布式为[Ar]3d54s1 |
分析 A、A元素基态原子的最外层有三个未成对电子,最内层有2个电子,根据构造原理可知,其电子排布式为:1s22s22p3或者1s22s22p63s23p3;
B、负一价离子的电子层结构与氩相同,其基态原子的核电荷数为18-1=17,据此分析;
C、正三价离子的3d能级为半充满,即离子的排布式为[Ar]3d5,据此分析;
D、某元素基态原子的M层全充满即排满18个电子,N层没有成对电子,只有一个未成对电子,则只有1个电子,据此分析.
解答 解:A、A元素基态原子的最外层有三个未成对电子,最内层有2个电子,根据构造原理可知,其电子排布式为:1s22s22p3或者1s22s22p63s23p3,所以元素符号可能为N或者P,故A错误;
B、负一价离子的电子层结构与氩相同,其基态原子的核电荷数为18-1=17,则基态原子价电子排布式为3s23p5,故B错误;
C、正三价离子的3d能级为半充满,即离子的排布式为[Ar]3d5,则基态原子排布式为[Ar]3d64s2,故C正确;
D、某元素基态原子的M层全充满即排满18个电子,N层没有成对电子,只有一个未成对电子,则只有1个电子,所以基态原子的电子排布式为[Ar]3d104s1,故D错误;故选:C.
点评 本题考查原子核外电子的排布规律以及构造原理的应用,以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质掌握程度,难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑧ | B. | ①③⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
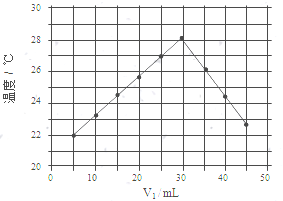 水不仅是包括人类在内所有生命生存的重要资源,也是化学反应中的重要物质:
水不仅是包括人类在内所有生命生存的重要资源,也是化学反应中的重要物质:
| 物质 | H-H | O=O | H-O |
| 键能/(kJ•mol-1) | 436 | 498 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL | B. | 250mL | C. | 200mL | D. | 100mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
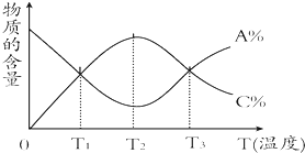
| A. | 该反应在T1、T3温度时达到化学平衡 | |
| B. | 该反应在T2温度时未达到化学平衡 | |
| C. | 升高温度,平衡会向正反应方向移动 | |
| D. | 该反应的正反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氧、干冰、硫酸、烧碱、氯化钠 | B. | 碘酒、冰、盐酸、烧碱、食盐 | ||
| C. | 氢气、二氧化硫、硝酸、纯碱、硝酸钾 | D. | 铜、硫酸钠、醋酸、石灰水、氯化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、苯的同系物均不能使酸性KMnO4溶液褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 芳香烃可以来自于煤干馏产品中的煤焦油 | |
| D. | 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
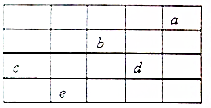 如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )
如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )| A. | b元素除0价外,只有一种化合价 | |
| B. | 五种元素中,c元素的天然氧化物可被称为刚玉 | |
| C. | b、d气态氢化物溶于水,溶液的酸性:b>d | |
| D. | c、d气态氢化物的稳定性:d>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com