
最近有研究人员发现了一种处理高浓度乙醛废水的新方法—隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如右图所示。下列说法不正确的是
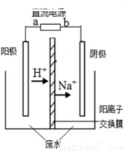
A.若以CH4—空气燃料电池为直流电源,燃料电池的a极应通入空气
B.阳极反应CH3CHO -2e- + H2O = CH3COOH +2H+
C.电解过程中,阴极区Na2SO4的物质的量增大
D.电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2
科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:选择题
某有机物的结构简式为HO-CH2CH= CHCH2-COOH,该有机物不可能发生的化学反应为( )
A.水解 B.酯化 C.加成 D.氧化
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:填空题
2011年3月,日本发生9级地震,地震引发海啸及伤亡。灾区重建面临多种困难,其中饮水安全是重要问题之一。高铁酸钾是一种重要的绿色净水剂,具有净水和消毒双重功能。某课外学习小组设计如下方案制备高铁酸钾:
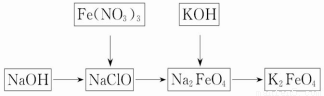
(1)高铁酸钾中铁元素的化合价为_______价,推测它具有的化学性质是____ __。
(2)在次氯酸钠(NaClO,84消毒液的主要成分)溶液中加入烧碱固体形成碱性环境,将研磨的硝酸铁少量多次地加入到上述溶液中,冰浴中反应1h。发生的离子反应为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,氧化剂是________。将KOH加入到反应后的溶液搅拌半小时。静置,抽滤粗产品。该反应的化学方程式为2KOH+Na2FeO4====K2FeO4+2NaOH。根据复分解反应原理,高铁酸钠的溶解度________高铁酸钾的溶解度(填“大于”、“小于”或“等于”)。
(3)在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色(+6价铬转化成+3价铬)。有关离子方程式为FeO42-+CrO2-+2H2O====CrO42-+Fe(OH)3↓+OH-,2CrO42-+2H+====Cr2O72-+H2O,Cr2O72-+6Fe2++14H+====2Cr3++6Fe3++7H2O
现称取5.00 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00 mL,再用稀硫酸酸化,用0.100 0 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液30.00 mL。计算上述实验制得的样品中,高铁酸钾的质量分数为__________;
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列各组中的离子因发生氧化还原反应而不能大量共存的是
A.H+、Na+、CO32—、Cl— B.Ca2+、K+、S2﹣、ClO—
C.Fe2+、CO32—、Cl—、NO3— D.HCO3—、Br—、OH—、SO42-
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:填空题
[化学——有机化学基础](13分)
某课题组以甲苯为主要原料,采用以下路线合成化妆品防霉剂:对—羟基苯甲酸乙酯。


请回答:
(1)产品的摩尔质量为_____________________。
(2)在①~⑥的反应中属于取代反应的有_______________________。
(3) 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 。
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 。
(4) 的同分异构体很多,其中符合下列条件有______种。
的同分异构体很多,其中符合下列条件有______种。
①遇到FeCl3溶液出现显色现象;②能发生水解反应;③能发生银境反应;④无-CH3结构。上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为 。
(5)高分子化合物 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图:

查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:选择题
下列说法正确的是:①植物油和裂化汽油都可以使溴水褪色;②糖类、油脂和蛋白质都能发生水解反应;③蛋白质溶液中加入浓的硫酸铵溶液会有沉淀析出;④防腐剂福尔马林可用作食品保鲜剂;⑤乙醇、乙酸、乙酸乙酯都能发生取代反应;⑥汽油、甘油和花生油都是混合物,无固定的沸点,只有花生油能与氢氧化钠溶液反应
A.①③⑤ B.①②⑤ C.②④⑥ D.②③⑥
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
将3.2 g Cu跟30.0 mL 10.0 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO3-的物质的量为
A.0.5a mol B.(0.1+a)mol
C.0.1a mol D.2a mol
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
检验某未知溶液中是否含有SO42-的下列操作中最合理的是
A.加入硝酸酸化的Ba(NO3)2溶液
B.先加HNO3酸化,再加Ba(NO3)2溶液
C.先加盐酸酸化,再加BaCl2溶液
D.加入盐酸酸化了的BaCl2溶液
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
A.0.1 ( b – 2a ) mol/L B.10 ( 2a – b ) mol/L
C.10 ( b – a ) mol/L D.10 ( b – 2a ) mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com