
分析 (1)沙子不溶于水,而NaCl溶于水;
(2)溴不易溶于水,易溶于有机溶剂;
(3)水和汽油分层;
(4)二者沸点不同,可蒸馏分离;
(5)可蒸发结晶分离.
解答 解:(1)沙子不溶于水,而NaCl溶于水,则选F分离,故答案为:F;'
(2)溴不易溶于水,易溶于有机溶剂,则选A分离,故答案为:A;
(3)水和汽油分层,可用分液的方法分离,故答案为:D;
(4)二者沸点不同,可蒸馏分离,故答案为:E;
(5)氯化钠溶于水,水易挥发,可用结晶的方法分离,故答案为:C.
点评 本题考查物质的分离、提纯,为高频考点,侧重学生的分析、实验能力的考查,注意把握物质的性质的异同以及实验的严密性、可行性的评价,难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| SiHCl3 | -126.5℃ | 33.0 | 易与水强烈反应,空气中易自然 |
| SiCl4 | -70 | 57.6 | 易水解 |
| HCl | -114.2 | -84.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
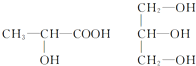 按要求完成下列问题.
按要求完成下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示,喷泉实验停止后,两个烧瓶内溶液的溶质的物质的量浓度(c)和溶质的质量分数(w)关系是( )| A. | c和w都不同 | B. | c和w都相同 | C. | c相同,w不同 | D. | w相同,c不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用H2O2制氧气 | B. | 工业上用氨气制硝酸 | ||
| C. | 实验室用浓HNO3制NO2气体 | D. | 实验室用氯化铵制氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油和植物油都是混合物,且属于不同类的有机物 | |
| B. | 甲酸的性质与乙酸类似,都不能被酸性高锰酸钾溶液氧化 | |
| C. | 用酸性K2Cr2O7 溶液鉴别乙醇与乙醛溶液 | |
| D. | 纤维素、蔗糖、葡萄糖和淀粉酶在一定条件下都可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
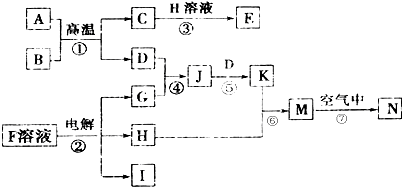
 ,N的化学式为Fe(OH)3.
,N的化学式为Fe(OH)3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com