
| A. | 标准状况下,22.4 L SO3中含有氧原子数目为3.0NA | |
| B. | 常温常压下,12.0 gNaHSO4中含有离子总数为0.3NA | |
| C. | 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA | |
| D. | 在1 L 0.1 mol•L-1碳酸钠溶液中,阴离子总数大于0.1NA |
分析 A.气体摩尔体积使用对象为气体;
B.求出硫酸氢钠的物质的量,然后根据1mol硫酸氢钠中含1mol钠离子和1mol硫酸氢根来分析;
C.合成氨气的反应为可逆反应,不能进行到底;
D.碳酸根离子水解生成氢氧根离子和碳酸氢根离子.
解答 解:A.标准状况下,三氧化硫不是气体,22.4 L SO3物质的量不是1mol,所以无法计算氧原子数,故A错误;
B.12.2g硫酸氢钠的物质的量为n=$\frac{12g}{120g/mol}$=0.1mol,而1mol硫酸氢钠中含1mol钠离子和1mol硫酸氢根,故0.1mol硫酸氢钠中含0.1mol钠离子和0.1mol硫酸氢根离子,即共0.2mol,为0.2NA个,故B错误;
C.密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应生成的氨气小于0.2mol,所以转移电子的数目小于0.6NA,故C错误;
D.常温下,100mL 1mol•L-1 Na2CO3溶液中,碳酸根离子水解生成氢氧根离子和碳酸氢根离子,阴离子总数大于0.1NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的应用,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意盐类的水解,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/L | B. | 1 mol/L | C. | 3 mol/L | D. | 4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7gH2O2中含有的电子总数为0.9NA | |
| B. | 92g NO2和N2O4的混合气中含有的氮原子数为2NA | |
| C. | 标准状况下,28 g CO与22.4 L O2所含原子数相等 | |
| D. | 1 mol FeCl3完全水解转化为氢氧化铁胶体后生成NA个胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O的电离方程式:NH3•H2O═NH4++OH- | |
| B. | 铁发生吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- | |
| C. | 碳酸钠水解的离子方程式:CO32-+2H2O═2OH-+H2CO3 | |
| D. | 甲烷的燃烧热是890kJ/mol,则甲烷燃烧的热化学方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=+890kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
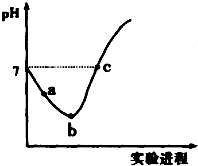 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| B. | b点所示的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| D. | c 点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用冰醋酸、蒸馏水和容量瓶等可以配制pH=1的醋酸溶液 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 反应SiO2(s)+3C(s)═SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
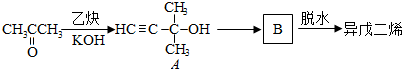
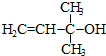 .
. 的合成路线.
的合成路线.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com