
| A、a=b时:c(OH-)=c(H+)+c(HS-) |
| B、a=2b时:c(S2-)>c(HS )>c(OH-)>c(H+) |
| C、a=3b时:C(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D、a=4b时:4c(Na+)=5c(S2-)+5c(HS-)5c(H2S) |


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
| A、水电离的c(H+):①=②=③=④ |
| B、将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:①最大 |
| D、向溶液中加入100mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeSO4溶液中:K+、H+、Cl-、NO3- |
| B、c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、Cl- |
| C、使甲基橙变黄的溶液中:Na+、K+、SO42-、AlO2- |
| D、和铝反应产生氢气的溶液中:K+、Ba2+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+92.3 kJ?mol-1 |
| B、-92.3 kJ?mol-1 |
| C、-369.2 kJ?mol-1 |
| D、+184.6 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用含氢氧化铝的药物治疗胃酸过多症:OH-+H+=H2O | ||||
B、用亚硫酸钾溶液吸收硫酸工业尾气中的SO2:SO2+S
| ||||
| C、右图所示电池的反应:Cu2++2Ag=Cu+2Ag+ | ||||
| D、用稀硫酸洗涤粘在试管壁上的氧化亚铜:Cu2O+2H+=2Cu2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
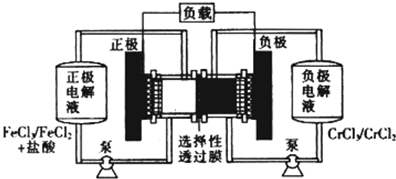
| A、充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B、电池放电肘,负极的电极反应式为Fe2+-e-=Fe3+ |
| C、电池放电时,Cl-从负极室穿过选择性透过膜移向正极室 |
| D、放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知,中学化学常见的一些物质有如下图转化关系(转化关系中的某些产物已略去).其中,物质A、D、G是单质,D的单质在黄绿色气体中燃烧生成的产物溶于水得到E,黑色物质C有磁性是某金属矿物的主要成份,F是混合物,H是极易溶于水的碱性气体.
已知,中学化学常见的一些物质有如下图转化关系(转化关系中的某些产物已略去).其中,物质A、D、G是单质,D的单质在黄绿色气体中燃烧生成的产物溶于水得到E,黑色物质C有磁性是某金属矿物的主要成份,F是混合物,H是极易溶于水的碱性气体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com