
【题目】工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3,难溶于水),其中一部分铁元素在风化过程中会转化为+3价。

已知:TiOSO4遇水会水解。
(1)步骤①中,钛酸亚铁与硫酸反应的离子方程式为__________________。
(2)步骤③中,实现混合物的分离是利用物质的___________(填字母序号)。
a. 熔沸点差异 b. 溶解性差异 c. 氧化性、还原性差异
(3)步骤④的操作是_______________(填操作名称)。

(4)步骤④中将TiO2+转化为H2TiO3的原理TiO2++2H2O ![]() H2TiO3+ 2H+,该反应的△H_______0(填>或<);加水稀释,平衡_________(填“正向”、“逆向”或“不”)移动。
H2TiO3+ 2H+,该反应的△H_______0(填>或<);加水稀释,平衡_________(填“正向”、“逆向”或“不”)移动。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________。
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。在制备金属钛前后,CaO的总量不变,其原因是(请用化学方程式解释)______________________________。
【答案】 FeTiO3 + 4H+ = Fe2+ + TiO2++2H2O b 过滤 > 正向 MnO2 + 2Fe2+ + 4H+ === Mn2+ + 2Fe3+ + 2H2O 2CaO === 2Ca + O2↑, 2Ca + TiO2 ![]() Ti + 2CaO,或: 阴极:2Ca2+ + 4e- == 2Ca 阳极:2O2- - 4e- == O2↑,2Ca + TiO2
Ti + 2CaO,或: 阴极:2Ca2+ + 4e- == 2Ca 阳极:2O2- - 4e- == O2↑,2Ca + TiO2 ![]() Ti + 2CaO
Ti + 2CaO
【解析】本题考查化学工艺流程,(1)根据流程①,以及FeTiO3难溶于水,因此钛酸亚铁与硫酸反应的离子方程式为:FeTiO3 + 4H+= Fe2++ TiO2++2H2O;(2)步骤③是冷却结晶,得到FeSO4·7H2O,因此利用的是物质的溶解性差异,故b正确;(3)步骤④在热水中得到沉淀和溶液,因此操作步骤是过滤;(4)步骤④是在热水中进行,相当于升温,平衡向生成H2TiO3方向进行,根据勒夏特列原理,该反应是吸热反应,即△H>0,,加水稀释,离子浓度降低,根据勒夏特列原理,应向正反应方向进行移动;(5)废液中含有Fe2+,以还原性为主,MnO2作氧化剂,被还原成+2价Mn,Fe2+被氧化成Fe3+,因此有Fe2++MnO2+→Fe3++Mn2+,根据化合价升降进行配平,即有MnO2+2Fe2+→Mn2++2Fe3+,根据电荷守恒和原子守恒,因此离子反应方程式为:MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O;(6)根据电解装置图,在阴极上发生Ca2++2e-=Ca,阳极上发生2O2--4e-=O2,总反应式为2CaO ![]() 2Ca+O2↑,根据装置图,以及整个过程中CaO的总量不变,说明在装置的右侧产生CaO,即发生的反应是2Ca + TiO2 = Ti + 2CaO。
2Ca+O2↑,根据装置图,以及整个过程中CaO的总量不变,说明在装置的右侧产生CaO,即发生的反应是2Ca + TiO2 = Ti + 2CaO。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体。某研究小组用下图所示的实验装置,利用浓氨水、干冰等作原料制备氨基甲酸铵。
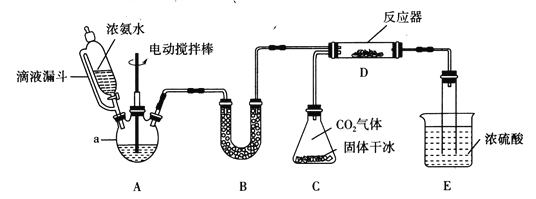
(1)仪器a的名称是____________;与分液漏斗相比,使用滴液漏斗的优点是:______________________________________。
(2)装置B中盛装药品的名称是________________。
(3)写出装置D中发生反应的化学方程式:__________________________________。
(4)装置E的作用之一是控制原料气按反应计量系数充分反应。若反应初期观察到装置内浓硫酸中产生气泡,应该______(填“加快”、“减慢”或“不改变”)产生氨气的流速;装置E的作用还有___________________________________________________。
(5)已知氨基甲酸铵可完全水解为碳酸氢铵。为测定氨基甲酸铵样品的纯度,取样品1.600g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000g。
①写出碳酸氢铵与足量石灰水反应的离子方程式:______________________________。
②样品中氨基甲酸铵的质量分数为_____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2L标准状况下的甲烷和某单烯羟的混合气体通入足量的溴的四氯化碳溶液中充分反应,溴的四氯化碳溶液增加了12.6g.该烯羟对氢气的相对密度为21(相对密度 ![]() )
)
①试确定该烯烃;
②求原混合气体中甲烷与烯烃的物质的量之比以及质量之比.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的CH4和NH3相比较,下列结论错误的是
A. 它们的分子个数比为17:16 B. 它们的原子个数比为17:16
C. 它们的氢原子个数比为17:12 D. 它们所含氢元素的质量比为17:12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu粉放入稀H2SO4中,无现象,当再加入一种盐后,Cu粉逐渐溶解,此盐是
A. NaCl B. CuSO4 C. KNO3 D. Na3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选用适当的试剂和除杂方法除去下列各物质中的杂质(括号中为杂质),将所选试剂和操作的名称填写在表格中.
序号 | 物质 | 试剂 | 除杂方法 |
① | 甲烷(C2H4) | ||
② | 硝基苯(混合酸) | ||
③ | KNO3(NaCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是
A. 浓硝酸保存在无色玻璃试剂瓶中
B. 少量的钠保存在煤油中
C. 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中
D. 新制的氯水通常保存在棕色玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关食物中营养素的说法正确的是( )
A.维生素C能防治坏血病B.摄入过多的淀粉不会发胖
C.油脂的成分是高级脂肪酸D.蛋白质水解的最终产物是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到:
![]() +H2SO4
+H2SO4![]()
![]() +H2O
+H2O
实验室可利用如图所示装置合成对氨基苯磺酸。实验步骤如下:

①在一个250 mL三颈烧瓶中加入10 mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18 mL浓硫酸。
②将三颈烧瓶置于油浴中缓慢加热至170~180 ℃,维持此温度2~2.5 h。
③将反应液冷却至约50 ℃后,倒入盛有100 mL冷水的烧杯中,玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干(100 mL水在20 ℃时可溶解对氨基苯磺酸1.08 g,在100 ℃时可溶解6.67 g)。
(1)装置中冷凝管的作用是____________________。
(2)步骤②中采用油浴加热,用油浴加热的优点是____________________。
(3)步骤③用少量冷水洗涤晶体的好处是____________________。
(4)步骤③和④均进行抽滤,在抽滤后停止抽滤时,应注意先__________________,然后__________________,以防倒吸。
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是____________________________。每次抽滤后均应将母液收集并适当处理,其目的是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com