
| A. | Cl2+H2O═HCl+HClO | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2Na+2H2O═4NaOH+H2↑ | D. | 2H2O═2H2↑+O2↑ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 .
. ,该晶体中含微粒间的作用有:离子键和非极性键.
,该晶体中含微粒间的作用有:离子键和非极性键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: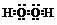 | B. | 磷原子的结构示意图: | ||
| C. | 乙醇的结构式:C2H6O | D. | 乙酸的结构简式:C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
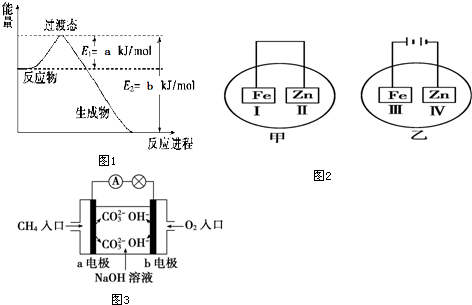
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体系压强保持不变 | B. | 混合气体颜色保持不变 | ||
| C. | SO3和NO的体积比保持不变 | D. | 每消耗1molSO3的同时生成1molNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
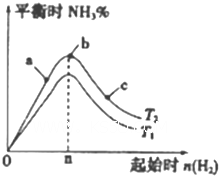
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com