
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。

(1)若A为短周期元素的金属单质,D为短周期元素的非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式为_____________。
(2)若A是常见的金属单质,D、F是气体单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是________________。已知1g D与F反应生成B(气态)时放出92.3kJ热量,写出该反应的热化学方程式:_______________________。
(3)若A、D、F都是短周期非金属元素的单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________,B固体属于____________晶体。
【答案】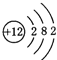 C + 4HNO3(浓)=4NO2 ↑+ CO2 ↑+2H2O 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- H2(g) +Cl2(g)=2HCl(g) △H=-184.6kJ/mol SiO2 + 2C = Si+ 2CO↑ 原子
C + 4HNO3(浓)=4NO2 ↑+ CO2 ↑+2H2O 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- H2(g) +Cl2(g)=2HCl(g) △H=-184.6kJ/mol SiO2 + 2C = Si+ 2CO↑ 原子
【解析】
(1)A为短周期元素的金属单质,D为短周期元素的非金属单质,所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,可知A的最外层电子数小于4且为偶数,D位于第二周期,A位于第三周期,那么A为Mg,D为C;F的浓溶液与A、D反应都有红棕色气体生成,红棕色气体为NO2,说明F为HNO3,C和浓HNO3反应生成CO2、NO2和H2O,B能和Mg反应生成C单质,即B为CO2,C为MgO,和浓HNO3反应生成Mg(NO3)2和水,E为Mg(NO3)2,据此作答;
(2)若A是常见的金属单质,D、F是气体单质,A为Fe,反应①在水溶液中进行,反应②也在水溶液中进行,那么B为酸,C为盐,D和F反应生成酸,盐和气体单质F反应生成E,Fe和气体单质直接反应生成E,因此F为Cl2,E为FeCl3,C为FeCl2,B为HCl,D为H2;
D为H2,F为Cl2,二者反应的方程式为:H2+Cl2=2HCl根据方程式计算反应热,并书写正确的热化学方程式;
(3)A、D、F都是短周期非金属元素的单质,且A、D所含元素同主族,A、F所含元素同周期,则A为C,B为SiO2,D为Si,F为O2,E为CO2,反应①为C与SiO2的反应。
(1)由分析可知A为Mg,原子结构示意图为:![]() ;反应④为C和浓HNO3反应,反应生成CO2、NO2和H2O,反应方程式为:C + 4HNO3(浓)=4NO2 ↑+ CO2 ↑+2H2O;
;反应④为C和浓HNO3反应,反应生成CO2、NO2和H2O,反应方程式为:C + 4HNO3(浓)=4NO2 ↑+ CO2 ↑+2H2O;
(2)C为FeCl2,F为Cl2,二者反应生成FeCl3,离子方程式为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-;1molH2与1molCl2反应生成2molHCl,1gH2与Cl2反应放出92.3kJ热量,那么1molH2与Cl2反应放出的热量为92.3kJ×2=184.6kJ,因此热化学方程式为:H2(g) +Cl2(g)=2HCl(g) △H=-184.6kJ/mol
(3)A为C,B为SiO2,二者反应生成Si和CO,反应方程式为:SiO2 + 2C = Si+ 2CO↑,B为SiO2,属于原子晶体。


科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中![]() 下列分析正确的是
下列分析正确的是![]()
![]()

A. ![]() 闭合,铁棒上发生的反应为
闭合,铁棒上发生的反应为![]()
B. ![]() 闭合,石墨棒周围溶液pH逐渐降低
闭合,石墨棒周围溶液pH逐渐降低
C. ![]() 闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D. ![]() 闭合,电路中通过
闭合,电路中通过![]() 个电子时,两极共产生
个电子时,两极共产生![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,AgI饱和溶液中c(Ag+)=1.22×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)=1.3×10-5 mol·L-1。若在5mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液。下列叙述中不正确的是
A.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是
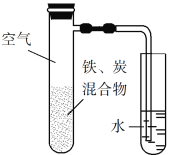
A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,能长时间保持稳定的放电电压。其电池总反应为:3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-= Zn(OH)2
B. 充电时阳极发生氧化反应,附近溶液碱性增强
C. 充电时每转移3mol电子,阴极有1.5molZn生成
D. 放电时正极反应为:FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。i.SO2+4I-+4H+![]() S↓+2I2+2H2O ii.I2+2H2O+SO2
S↓+2I2+2H2O ii.I2+2H2O+SO2![]() SO42- +4H++2I-
SO42- +4H++2I-
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
下列说法不正确的是( )
A. 水溶液中SO2歧化反应方程式为3SO2+2H2O ![]() 2H2SO4 +S↓
2H2SO4 +S↓
B. II是I的对比实验,则a=0.4
C. 比较I、II、III,可得出的结论是:I是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率
D. 实验表明,SO2的歧化反应速率IV>I,原因是反应i比ii快;IV中由反应ii产生的H+使反应i加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行的实验中,不能达到相应实验目的的是
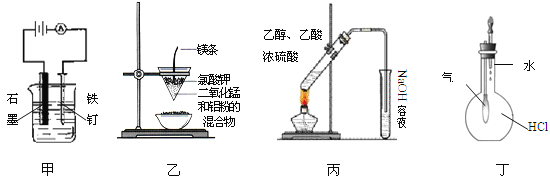
A.装置甲:防止铁钉生锈
B.装置乙:可制得金属锰
C.装置丙:实验室制取乙酸乙酯
D.装置丁:验证HCl气体在水中的溶解性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保护意义重大。
(1)红酒中添加一定量的SO2 可以防止酒液氧化,这应用了SO2 的___性。
(2)某水体中硫元素主要以S2O32-形式存在,在酸性条件下,该离子会导致水体中有黄色浑浊并可能有刺激性气味产生,原因是___________________________________。(用离子方程式说明)
(3)实验室采用滴定法测定某水样中亚硫酸盐含量:
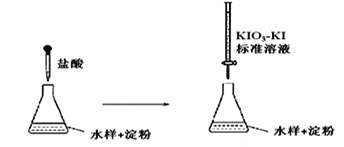
滴定时,KIO3 和KI 在盐酸作用下析出I2:5I-+ IO3- + 6H+ =3I2+3H2O
生成的I2 再和水样中的亚硫酸盐反应:I2 + SO32- + H2O = 2H++2I-+ SO42-
①滴定到终点时的现象是:________________________________
②若滴定前盛标准液的滴定管没有用标准液润洗,则测定结果将_________(填“偏大、偏小、不变”)。
③滴定终点时,100mL的水样共消耗x mL标准溶液。若消耗1mL标准溶液相当于SO32-的质量1g,则该水样中SO32-的含量为__________g / L
(4)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
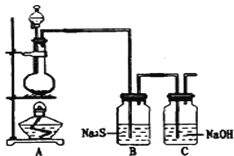
①若装置A的圆底烧瓶中盛装二氧化锰,则分液漏斗中盛装的试剂是_____________________
②装置B中实验现象为___________________________,证明氯元素的非金属性比硫元素的非金属性强。
③装置C中反应的作用是:____________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com