
【题目】碲(Te)元素在元素周期表中位于第ⅥA族,其単质是重要的工业原料。工业上可用电解法从铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)中提取单质碲,歩驟如下:
①将铜阳极泥在空气中焙烧使碲转化为TeO2;
②用NaOH溶液碱浸;
③以石墨为电极电解②所得溶液获得Te。
已知:TeO2微溶于水,易与较浓的强酸、强碱反应
下列说法不正确的是( )
A.Cu2Te中,Te的化合价是-2
B.歩骤②中,碱浸的子离方程式是:TeO2+2OH-=TeO32-+H2O
C.歩骤③中,阴极上发生反应的电极方程式是:TeO32-+4e-+6H+=Te+3H2O
D.在阳极区溶液中检验出有TeO42-存在,可能原因是阳极生成的氧气氧化TeO32-得到TeO42-
【答案】C
【解析】
工业上可从电解精炼铜的阳极泥(主要成分Cu2Te,还有少量的Ag、Au)中提取碲,铜阳极泥在空气中焙烧使碲转化为TeO2,其化学反应方程式为:Cu2Te+2O2![]() 2CuO+TeO2,用NaOH溶液碱浸,其化学反应方程式为:TeO2+2NaOH=Na2TeO3+H2O,以石墨为电极,电解Na2TeO3溶液时,溶液中的离子有Na+、H+、TeO32-、OH-,阴极得电子能力:TeO32- >H+>Na+,阴极的电极反应式为TeO32- +4e-+3H2O=Te↓+6OH-,阳极的电极反应式为4OH--4e-=2H2O+O2↑,亚碲酸根离子也可能发生氧化反应,其电极反应式为TeO32--2e-+2OH-= TeO42- +H2O。
2CuO+TeO2,用NaOH溶液碱浸,其化学反应方程式为:TeO2+2NaOH=Na2TeO3+H2O,以石墨为电极,电解Na2TeO3溶液时,溶液中的离子有Na+、H+、TeO32-、OH-,阴极得电子能力:TeO32- >H+>Na+,阴极的电极反应式为TeO32- +4e-+3H2O=Te↓+6OH-,阳极的电极反应式为4OH--4e-=2H2O+O2↑,亚碲酸根离子也可能发生氧化反应,其电极反应式为TeO32--2e-+2OH-= TeO42- +H2O。
A. S和Te为同主族元素,类比Cu2S,Cu2Te中,Te的化合价是-2,A正确;
B. TeO2与较浓的强酸、强碱反应,为两性氧化物,与碱强反应的化学反应方程式为:TeO2+2NaOH=Na2TeO3+H2O,其离子反应方程式为:TeO2+2OH-=TeO32-+H2O,B正确;
C.阴极上发生反应的电极方程式为: TeO32-+4e-+3H2O=Te↓+6OH-,C错误;
D. 阳极的电极反应式为4OH--4e-=2H2O+O2↑,亚碲酸根离子也可能发生氧化反应,其电极反应式为TeO32--2e-+2OH-= TeO42-+H2O,D正确;故答案为:C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活和环境密切相关。下列说法错误的是( )
A.煤的脱硫、汽车尾气实行国![]() 标准排放是为了提高空气质量
标准排放是为了提高空气质量
B.溴元素被称为“海洋元素”,从海水中提取溴常用热空气吹出法
C.![]() 可用于文物年代的鉴定,
可用于文物年代的鉴定,![]() 与
与![]() 互为同素异形体
互为同素异形体
D.废旧钢材焊接前分别用饱和![]() 溶液、
溶液、![]() 溶液处理焊点,运用了盐类水解原理
溶液处理焊点,运用了盐类水解原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用偏铝酸钠(NaA1O2)溶液电解法制备氢氧化铝的简易装置如图所示,其中两电极均为惰性电极。下列说法正确的是( )
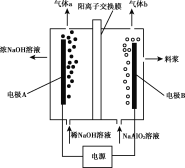
A.电极A为阳极
B.气体b为H2
C.所得料浆液的pH大于原料NaA1O2溶液的pH
D.该方法总反应方程式是:4NaA1O2+10H2O![]() 4A1(OH)3+4NaOH+O2↑+2H2↑
4A1(OH)3+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.23gNO2与足量水反应,转移的电子数约为6.02×1023
B.标准状况下,22.4L15NH3含有的质子数约为6.02×1024
C.常温下,1L0.1mo1L-1NH4NO3溶液中含有的NH4+数约为6.02×1022
D.密闭容器中,1molNO与0.5molO2充分反应后,容器中分子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g),CO2的平衡浓度c(CO2)与温度T的关系如图所示。
CO2(g)+H2(g),CO2的平衡浓度c(CO2)与温度T的关系如图所示。
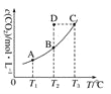
下列说法错误的是
A. 反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的 ΔH﹥0
CO2(g)+H2(g)的 ΔH﹥0
B. 在T2时,若反应处于状态D,则一定有ν(正)﹥ν(逆)
C. 平衡状态A与C相比,平衡状态A的c(CO)大
D. 若T1、T2时的平衡常数分别为K1、K2,则K1﹤K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为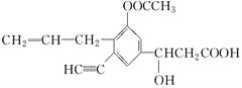 ,分析其结构,并回答下列问题:
,分析其结构,并回答下列问题:
(1)写出其分子式:____________________________________________。
(2)其中含有____个不饱和碳原子,分子中有____个双键。
(3)分子中的极性键有__________(写出2种即可)。
(4)分子中的饱和碳原子有______个,一定与苯环处于同一平面的碳原子有______个。
(5)分子中C—C===O键角约为__________,H—C≡C键角约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六组物质,请按要求选择合适的番号填空:
A. O2和O3;B. ![]() 和
和![]() ;C. CH3―CH2―CH2―CH3和CH3―CH(CH3) CH3;D. 冰醋酸和乙酸;E. 甲烷和庚烷;F. 淀粉和纤维素
;C. CH3―CH2―CH2―CH3和CH3―CH(CH3) CH3;D. 冰醋酸和乙酸;E. 甲烷和庚烷;F. 淀粉和纤维素
(1)互为同位素的是________________;
(2)属于同系物的是________________;
(3)互为同分异构体的是____________;
(4)属于同一物质的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于________层,配位数是________;B属于________层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。

(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式,钋位于元素周期表的第________周期第__________族,元素符号是________,最外电子层的电子排布式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃时,将气体X和气体Y各1.6 mol充入10 L恒容密闭容器中,发生反应:X(g) +Y(g)2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
回答下列问题:
(1)反应0~2 min Z的平均速率v(Z)=________________
(2)温度为300℃时,该反应的化学平衡常数K=____________________
(3)右图表示该反应变化过程中物质的浓度与反应的时间变化关系。图中t2→t3间的曲线变化是由于下列哪种条件的改变所引起的_______

A.增大了压强 B.降低温度
C.增加了x和y的浓度 D.使用了催化剂
(4)若起始时向该容器中充入X、Y、Z各2.0 mol,则反应将向_______(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数=____________,平衡时n(Y)=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com