
(本题共14分)某课外兴趣小组成员为研究金属铜与强酸的反应,将9.6克铜粉分为三等份,进行了如下一些实验,请完成有关计算。
54.取其中一份与100mL一定浓度的硝酸反应,待固体完全溶解,产生的一氧化氮和二氧化氮混合气体在标准状况下的体积为0.896L。然后将剩余溶液稀释至1000mL,测得pH=0。请计算:生成的混合气体中一氧化氮的体积分数为______、反应前硝酸的物质的量浓度是__________。
55.再取另一份铜粉投入100mLpH=0的硫酸和硝酸混合液中,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。求反应前混合溶液中所含硫酸的物质的量是多少?(写出计算过程)
56.用NaOH溶液吸收氮氧化物是防止NOx污染的一种方法。
原理为:2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O
取最后一份铜粉溶于a mol/L过量的硝酸溶液30.0 ml中,假设硝酸的还原产物只有一氧化氮和二氧化氮。待反应结束后,将所剩溶液加水稀释至1000 m L,测得c(NO3-)=0.200 mol/L。若反应所生成的混合气体能被NaOH溶液完全吸收,试讨论a的取值范围。
54.0.75(3分);11.4mol/L(3分) 55.0.04 mol(4分) 56.8.3≤ a<10(4分)
【解析】
试题分析:54、9.6g铜的物质的量的是9.6g÷64g/mol=0.15mol,每一份中生成硝酸铜0.05mol,剩余硝酸的物质的量是1L×1mol/L=1mol。被还原硝酸的物质的量是0.896L÷22.4L/mol=0.04mol,则反应前硝酸的物质的量是0.05mol×2+1mol+0.04mol=1.14mol,所以反应前硝酸的浓度是1.14mol÷0.1L=11.4mol/L。每一份中铜失去电子的物质的量是0.05mol×2=0.1mol,设生成的混合气体中一氧化氮的物质的量是xmol、NO2是ymolk,则x+y=0.04、3x+y=0.1,解得x=0.03mol、y=0.01mol,则生成的混合气体中一氧化氮的体积分数为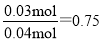 。
。
55、NO的物质的量是0.448L÷22.4L/mol=0.02mol,投入的铜是0.05mol,根据方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知铜完全反应需要氢离子的物质的量是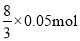 ,溶液中氢离子是0.1L×1.0mol/L=0.1mol,这说明氢离子不足,铜过量,硝酸完全反应。根据氮原子守恒可知硝酸的物质的量是0.02mol,所以原溶液中硫酸的物质的量是
,溶液中氢离子是0.1L×1.0mol/L=0.1mol,这说明氢离子不足,铜过量,硝酸完全反应。根据氮原子守恒可知硝酸的物质的量是0.02mol,所以原溶液中硫酸的物质的量是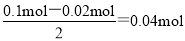 。
。
56、根据方程式可知如果全部生成NO2,则可以完全被氢氧化钠溶液吸收,则根据电子守恒可知生成NO2的物质的量为0.1mol,因此0.03a-0.2=0.1,解得a=10;如生成NO和NO2,则根据方程式可知气体要完全被吸收,必须满足NO2的物质的量大于或等于NO的物质的量。假设混合气体中NO2和NO的物质的量分别是xmol、ymol,每一份中铜失去电子的物质的量是0.1mol,所以根据电子得失守恒可知x+3y=0.1,根据N原子守恒可知x+y=0.03a-0.2,解得x=0.045a-0.35,y=0.15-0.015a。则有(0.045a-0.35)≥(0.15-0.015a)解得a≥8.3,所以a的取值范围是8.3≤ a<10。
考点:考查铜与硝酸反应的有关计算


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源:2014-2015黑龙江省绥化市三校高一上学期期末联考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.CuSO4溶液与Ba(OH)2溶液反应:Ba2+ + SO42? = BaSO4↓
B.NaHSO4溶液和NaHCO3溶液反应:H+ + HCO3? = H2O + CO2↑
C.氯化铝溶液中加入过量氨水:Al3+ + 4NH3?H2O = AlO2- + 4NH4+ + 2H2O
D.澄清石灰水中通入过量二氧化碳:Ca2+ +2OH? +CO2 = CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津南开区高三上学期第三次月考理综化学试卷(解析版) 题型:推断题
(14分)在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰。H可用于制造光导纤维,J是一种乳白色凝胶状沉淀。(部分生成物和部分反应条件未列出) 请回答下列问题:

(1)形成单质D的元素在周期表中的位置
(2)形成C、D、F单质的元素半径由大到小的顺序(填写元素符号)
(3)C长期暴露在空气中,最终产物是
(4)H在高温下与碳反应方程式为 ,若转移4mol电子参加反应的碳为 mol。
(5)写出反应①的离子方程式
(6)写出反应②的化学方程式
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省攀枝花市高三上学期第二次统考理综化学试卷(解析版) 题型:选择题
化学知识与日常生活密切相关。下列说法不正确的是
A.镀锡铁板比镀锌铁板更耐腐蚀
B.水常温下呈液态,冰浮在水面上,均与氢键有关
C.用纯碱溶液清洗油污时,加热可增强其去污能力
D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市普高高三上学期第一次诊断理综化学试卷(解析版) 题型:选择题
已知反应:①SeO2+4KI+4HNO3 =Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O。下列叙述正确的是
A.反应①中Se是氧化产物,I2是还原产物
B.反应②中浓H2SO4是氧化剂,SeO2是还原产物
C.反应①中每有1.0mol I2生成,转移电子数目为4NA
D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:填空题
(本题共12分)氯化钙是典型的离子型卤化物。完成下列填空:
28.氯原子核外电子排布式为 ,其原子核外能量不同的电子有 种,最外层上有 种不同运动状态的电子,钙元素在元素周期表中位于 。
某研究小组以CaCl2和H2为原料,试图制备+1价Ca的化合物,结果发现产物中只有两种化合物甲和乙。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.29%、46.41%;已知甲与水反应可得H2,乙的水溶液显酸性。
29.该研究小组是否成功制得了+1价Ca的化合物? (填“是”或“否”)。甲的化学式是 。
30.写出甲与水反应得H2的化学方程式 。现欲检验该反应所得溶液中是否含有Cl-,请简述检验的方法 。
31.乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
向含S2—、Fe2+、Br—、I—各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是

查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:计算题
(本题共14分)自然界中,金属硫化物矿床常因发生表生氧化及次生富集作用,产生辉铜矿(Cu2S)与铜蓝(CuS)。
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将四份质量不同的某Cu2S和CuS混合物样品分别与100mL 5mol/L的稀硝酸充分反应,样品质量与产生气体的体积(已折合成标准状况)如下表所示:
实验编号 | 甲 | 乙 | 丙 |
样品质量(g) | 9.6 | 12.8 | 64.0 |
气体体积(L) | 5.04 | 6.72 | V |
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
53.用质量分数为0.63、密度为1.42g/cm3的浓硝酸配置100mL、5mol/L的稀硝酸,需浓硝酸的体积为 。(保留1位小数)
54.甲实验结束后,溶液中c(NO3-) = 。
55.混合物样品中Cu2S、CuS的物质的量之比是多少?(写出计算过程)
56.乙实验结束后,溶液中氢离子的浓度是多少?(写出计算过程)
57.计算丙实验中产生气体的体积(V)。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:选择题
将一镁铝合金(含0.1 molMg,0.2 molAl)完全溶于由0.2 molNH4Cl和1 molHCl组成的混合溶液中,在反应后的溶液中慢慢加入Na2O2粉末,加热排出气体,则加入Na2O2的量和生成气体及沉淀的量的关系正确的是
A | B | C | D | |
Na2O2(mol) | 0.2 | 0.4 | 0.6 | 0.7 |
沉淀(mol) | 0 | 0.2 | 0.3 | 0.1 |
气体(mol) | 0.3 | 0.4 | 0.5 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com