
【题目】下列事实不能用勒夏特列原理解释的是
A.实验室中常用排饱和食盐水的方法收集Cl2
B.洗涤油污时热的纯碱溶液比冷的纯碱溶液效果更好
C.浓氨水中加入氢氧化钠固体时产生刺激性气味的气体
D.工业上使用催化剂提高SO2与O2合成SO3的效率
科目:高中化学 来源: 题型:
【题目】丙烷(C3H8)熔融盐燃料电池和锌蓄电池均为用途广泛的直流电源,放电时二者的总反应分别为C3H8+5O2=3CO2+4H2O,2Zn+O2=2ZnO。用丙烷(C3H8)燃料电池为锌蓄电池充电的装置如图所示,下列说法不正确的是

A. 物质M为CO2
B. 燃料电池消耗1mo1 O2时,理论上有4 mol OH-透过b膜向P电极移动
C. a膜、b膜均适宜选择阴离子交换膜
D. 该装置中,锌蓄电池的负极反应式为Zn+2OH--2e-=ZnO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)在工业、农业、医药及食品等行业均有广泛的应用。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如图所示(部分流程步骤已省略):
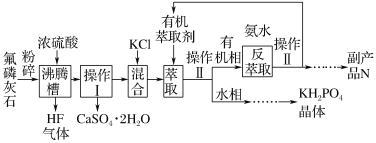
其中,萃取是因为KCl和H3PO4产生的HCl易溶于有机萃取剂。请回答下列问题:
(1)氟磷灰石(Ca5P3FO12)中磷元素的化合价是____。
(2)用化学反应原理解释KCl和H3PO4生成KH2PO4的原因: ________。
(3)沸腾槽不能采用陶瓷材质的原因是_______(用化学方程式表示)。
(4)在得到N的流程中“……”的操作步骤是______、洗涤、干燥。
(5)在萃取过程中,影响萃取率的因素复杂,下图是投料比![]() 对萃取率的影响曲线,在实际操作中,应选择投料比
对萃取率的影响曲线,在实际操作中,应选择投料比![]() 的范围是___(填序号)。
的范围是___(填序号)。
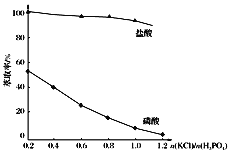
A.0.2~0.4 B.0.4~0.6 C.0.6~0.8 D.0.8~1.0 E.1.0~1.2
(6)电解法制备KH2PO4是用石墨作电极,将电解槽分为a区和b区,中间用阳离子交换膜隔离,a区为3 mol·L-1 H3PO4,b区为3 mol·L-1 KCl。阳极区为____(填“a”或“b”)区,其电极反应式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
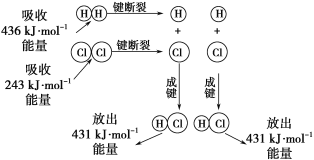
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下:

下列说法不正确的是
A.元素甲位于现行元素周期表第四周期第ⅢA族
B.元素乙的简单气态氢化物的稳定性强于CH4
C.原子半径比较:甲>乙>Si
D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据如图所示实验装置,回答下列问题:
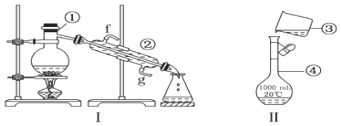
![]() 写出下列仪器的名称:
写出下列仪器的名称:![]() ______;
______;
![]() 若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器有______,将仪器补充完整后进行的实验操作的名称为______;
若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器有______,将仪器补充完整后进行的实验操作的名称为______;![]() 的进水口是______
的进水口是______![]() 填f或
填f或![]()
![]() 某同学用装置Ⅱ配制
某同学用装置Ⅱ配制![]() NaCl溶液,指出图中的错误操作______.
NaCl溶液,指出图中的错误操作______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业合成氨的原理是N2(g)+3H2(g)![]() 2NH3(g) △H=-93.0kJ·mol-1
2NH3(g) △H=-93.0kJ·mol-1
(1)已知一定条件下:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) △H=+l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为___。
4NH3(g)+3O2(g) △H=+l 530.0kJ·mol一1。则氢气燃烧热的热化学方程式为___。
(2)如图,在恒温恒容装置中进行合成氨反应。
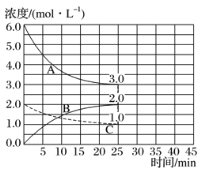
①表示N2浓度变化的曲线是____。
②前25min内,用H2浓度变化表示的化学反应速率是____。
③在25min末刚好平衡,则平衡常数K=____。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是___。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应①:4NH3(g)+6NO(l)![]() 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)![]() 5N2O(g)+3H2O(g)△H>0。平衡混合气中N2与N2O含量与温度的关系如图。
5N2O(g)+3H2O(g)△H>0。平衡混合气中N2与N2O含量与温度的关系如图。

请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是___,导致这种规律的原因是___(任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3(g)+3O2=2N2+6H2O。则负极电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①AgCl②铜③液态醋酸④CO2⑤H2SO4⑥Ba(OH)2固体⑦NaHCO3⑧稀硝酸⑨熔融FeCl3 ⑩NaHSO4
(1)上述状态下可导电的是_________;(填序号,下同)属于强电解质的是________;属于非电解质的是______.
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为_______________________________
(3)用⑨的饱和溶液制备Fe(OH)3胶体的离子方程式_______________________ 足量的④通入⑥的溶液中的离子方程式______________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com