
| A. | “尿毒症”患者做血液透析治疗 | |
| B. | FeCl3溶液中滴入NaOH溶液出现红褐色沉淀 | |
| C. | 在河流入海处易形成沙洲 | |
| D. | 在豆浆中加入盐卤制豆腐 |
分析 A、血液是胶体;
B、氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠;
C、河水是胶体;
D、豆浆是胶体,能发生胶体的聚沉.
解答 解:A、血液是胶体,当病人患有尿毒症时,血液中的毒素不能排出,要做血液的透析来治疗,和胶体的性质有关,故A错误;
B、氯化铁和氢氧化钠反应生成红褐色的氢氧化铁沉淀和氯化钠,而得不到氢氧化铁胶体,和胶体的性质无关,故B正确;
C、河水是胶体,在入海时遇到氯化钠溶液,发生了胶体额聚沉,从而形成三角洲,和胶体的性质有关,故C错误;
D、豆浆是胶体,遇盐卤能发生胶体的聚沉,和胶体的性质有关,故D错误.
故选B.
点评 本题考查了胶体的性质和制备,应注意的是将氯化铁和碱溶液混合后得到的是氢氧化铁沉淀而非胶体.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该氧原子的摩尔质量为$\frac{12b}{a}$g/mol | B. | 1 mol 该氧原子质量为幽a NAg | ||
| C. | xg 该氧原子所含的电子数为$\frac{16x}{a}$ | D. | yg 该氧原子的中子数一定为$\frac{8y}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | B的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
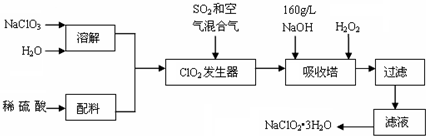
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com