
| A、X2>Y2>Z2>W2 |
| B、Y2>W2>X2>Z2 |
| C、Z2>X2>W2>Y2 |
| D、W2>X2>Z2>Y2 |


科目:高中化学 来源: 题型:
| A、3P2表示3P能级有两个轨道 |
| B、同一原子中1S、2S、3S电子的能量逐渐降低 |
| C、氢原子电子云的一个小黑点表示一个电子 |
| D、处于最低能量的原子叫基态原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
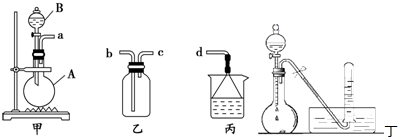
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象或预期试验先行 | 现象解释(用离子方程式表示) | ||
| 猜想② | (1) | 溶液PH=8 | --- | |
| 向PH=2的硫酸中滴加Na2S2O3溶液 | (2) | S2O
| ||
| 猜想③ | 向新制氯水(PH<2)中滴加少许Na2S2O3溶液 | 氯水颜色变浅 | (3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
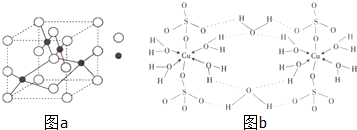
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔质量:g?mol-1 |
| B、密度:g?mL-1 |
| C、气体摩尔体积:L |
| D、阿伏加德罗常数:mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离常数(25℃) |
| HF: Ka1=3.6×10-4 |
| H3PO4: Ka1=7.5×10-3 Ka2=6.2×10-8 Ka3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-→H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:PO43->F->HPO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com