
分析 根据常见的放热反应有:所有的物质燃烧、金属与酸或水反应、中和反应、铝热反应、绝大多数化合反应等;
常见的吸热反应有:绝大数分解反应,以C、氢气和CO为还原剂的氧化还原反应(如C和CO2),八水合氢氧化钡与氯化铵的反应.
解答 解:①CaCO3分解是分解反应,故为吸热反应,故正确;
②钠与水反应是金属和水的反应,故为放热反应,故错误;
③所有的燃烧均为放热反应,故硫在O2中燃烧放热,故错误;
④CO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2CO是吸热反应,故正确;
⑤CaO+H2O═Ca(OH)2是化合反应,故为放热反应,故错误;
⑥C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2 是以碳为还原剂的氧化还原反应,故为吸热反应,故正确;
⑦N2与H2合成NH3 是化合反应,故为放热反应,故错误;
⑧NaOH和CH3COOH的反应是酸碱中和反应,故为放热反应,故错误.
故答案为:①④⑥.
点评 本题考查吸热反应和放热反应,难度不大,明确常见的吸热反应和放热反应是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 从C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 化学反应中的能量变化,通常表现为热量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②④ | C. | ①③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨中含有H2O,NH3•H2O,NH3,NH4+,NH2-等微粒 | |
| B. | 液氨中c(NH4+)•c(NH2-)是一个随温度升高而减小的常数 | |
| C. | 液氨的电离达到平衡时c(NH3)=c(NH4+)=c(NH2-) | |
| D. | 任何温度下,只要不加入其他物质,液氨中c(NH4+)和c(NH2-)一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何浓度的溶液都可以用pH来表示其酸碱性的强弱 | |
| B. | 某溶液中由水电离出的c(OH-)=1×10-a mol•L-1,若a>7,则该溶液的pH一定为14-a | |
| C. | 0.2 mol•L-1 CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| D. | 无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)•c(OH-)=1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由 1 mol CuFeS2 生成 1mol Cu,共消耗 2.75 molO2 | |
| B. | 该冶炼方法中产生大量的有害气体SO2,可回收用于制备硫酸 | |
| C. | 在反应③中,Cu2S既是氧化剂,又是还原剂 | |
| D. | 在反应①中,SO2既是氧化产物,又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
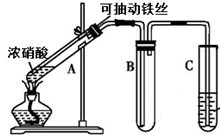 某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.
某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
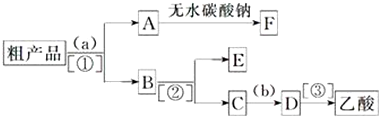
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
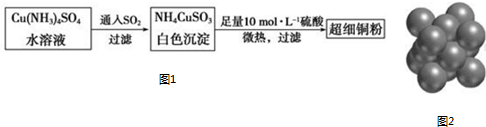
 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).
; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com