
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1, ①
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1, ②
①热化学方程式:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4 。
①该反应还原剂是 (写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。

①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
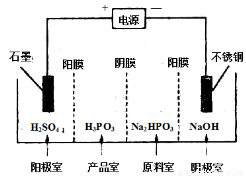
(4) 电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
(16分)(1)①Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=-217.4KJ/mol;(2分)
②阳;(2分)
(2)①H3PO2(2分);②1mol(2分);
(3)①c(CuCl2)>c(CuCl+)>c(CuCl3-)(2分);
②Cu2++Cl-═CuCl+(2分).
(4)①4OH--4e-=2H2O+O2↑(2分)
②HPO32-+2H+=H3PO3(2分)
【解析】
试题分析:(1)①根据盖斯定律可得Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H=(①+②)/3=(-768.2kJ·mol-1+116.0kJ·mol-1)/3=-217.4KJ/mol;
②粗铜精炼时,粗铜作阳极,纯铜作阴极;
(2)①根据还原剂的判断,元素化合价升高的物质作还原剂,在4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4 中P元素的化合价升高,所以还原剂是H3PO2;
②该反应中每生成4molCuH转移 12mol电子,所以每转移3 mol电子,生成CuH的物质的量为1mol;
(3)①由图可知,当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-);
②从图上可见,在c(Cl-)=1mol?L-1的氯化铜溶液中,主要是Cu2+与Cl-结合生成CuCl+,方程式为:Cu2++Cl-═CuCl+;
(4)①根据离子的放电顺序及溶液中离子的种类,在阳极放电的是氢氧根离子,所以阳极电极反应式为4OH--4e-=2H2O+O2↑;
②产品室中有亚磷酸生成,原料室中的磷酸氢根离子通过阴膜到达产品室,与通过阳膜到达产品室的氢离子结合生成亚磷酸,所以产品室中的离子方程式为HPO32-+2H+=H3PO3。
考点:考查盖斯定律的应用,氧化还原反应的计算,图像的分析,电解原理的应用


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源:2013-2014江苏省泰州市姜堰区高二下学期期中考试 化学试卷(解析版) 题型:选择题
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是
选项 | 混合物 | 试剂 | 分离方法 |
A. | 溴乙烷(乙醇) | 生石灰 | 蒸馏 |
B. | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
C. | 苯(硝基苯) | 蒸馏水 | 分液 |
D. | 苯甲酸(NaCl) | 蒸馏水 | 重结晶 |
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一期末模拟化学试卷(解析版) 题型:选择题
在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在的较多的阳离子是
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
处于同一周期的A、B、C、D四种短周期元素,其气态原子获得一个电子所放出的能量A>B>C>D。则下列关于A、B、C、D四种元素的说法中,正确的是
A.元素的非金属性依次增强 B.元素的电负性依次减小
C.元素的第一电离能依次增大 D.最高价氧化物对应水化物的酸性依次减弱
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
下列各组原子中,化学性质一定相似的是
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅两个电子的Y原子
C.2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子
D.最外层都只有一个电子的X、Y原子
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
700℃时,向容积为1 L的密闭容器中充入一定量的CO2和H2,发生反应:
CO2+H2(g)  CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO2)/mol | H2/ mol |
0 | 1.50 | 1.00 |
t1 |
| 0.40 |
t2 | 0.90 |
|
下列说法不正确的是
A.反应在t1 min内的平均速率为v(H2O)=0.60 /t1 mol·L-1·min-1
B.温度升至800℃,上述反应平衡常数为1.56,则正反应为放热反应
C.保持其他条件不变,向平衡体系中再通入1.00 molH2,与原平衡相比,达到新平时CO2转化率增大,H2的体积分数增大
D.保持其他条件不变,起始时向容器中充入1.00 molCO和1.50 molH2O,到达平衡时,c(CO2)=0.90 mol/L
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
下列表示对应化学反应或过程的离子方程式正确的是
A.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.用石墨作电极电解AlCl3溶液:2Cl-+2H2O  Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.亚硫酸氢钠溶液显酸性:NaHSO3=Na++H++ SO32-
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
儿茶素(其结构简式如图所示)是茶叶的主要活性成分,具有抗氧化、抗菌、除臭等作用。下列说法正确的是
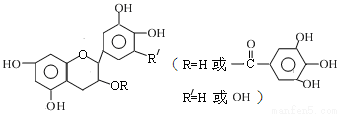
A.常温下,儿茶素不溶于水,也不溶于有机溶剂
B.儿茶素能与FeCl3溶液发生显色反应
C.1 mol儿茶素最多可与9mol NaOH反应
D.儿茶素一定不能发生水解反应
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
下列反应属于加成反应的是
A.2CH3CH2OH + 2Na →2CH3CH2ONa + H2↑
B.
C.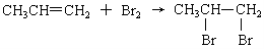
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com