
(14分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=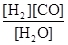
它所对应的化学反应为:
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+C02(g)  2C0(g) △H>O,K1 ①
2C0(g) △H>O,K1 ①
CO(g)+H20(g) H2(g)+C02(g),K2 ②
H2(g)+C02(g),K2 ②
C(s)+H20(g)  CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③
则K1、K2、K3,之间的关系是: 。
反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如N0、N02、N204等。对反应N2O4(g)  2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N204、N02的量),反应速率v与时间t关系如右图所示。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中N02的含量最高的一段时间是 。
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源:2011-2012学年福建省厦门市高三下学期期初考试化学试卷 题型:填空题
(14分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=
它所对应的化学反应为:
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+C02(g)  2C0(g) △H>O,K1
①
2C0(g) △H>O,K1
①
CO(g)+H20(g)  H2(g)+C02(g),K2
②
H2(g)+C02(g),K2
②
C(s)+H20(g)  CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③

则K1、K2、K3,之间的关系是: 。
反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。

简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如N0、N02、N204等。对反应N2O4(g)
 2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N204、N02的量),反应速率v与时间t关系如右图所示。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中N02的含量最高的一段时间是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省德州市高三上学期期末考试化学试卷 题型:填空题
(14分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:

(1)已知该产业链中某反应的平衡表达式为:K= ,它所对应的化学反应为:
,它所对应的化学反应为:
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+C02(g)  2C0(g),K1
①
2C0(g),K1
①
CO(g)+H20(g)  H2(g)+C02(g),K2
②
H2(g)+C02(g),K2
②
C(s)+H20(g)  CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③
则K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。

简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如N0、N02、N204等。对反应N2O4(g)  2N02(g)
△H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g)
△H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N204、N02的量),反应速率v与时间t关系如图所示。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中N02的含量最高的一段时间是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=![]() ,它所对应的化学反应为:
,它所对应的化学反应为:
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+C02(g) ![]() 2C0(g),K1 ①
2C0(g),K1 ①
CO(g)+H20(g) ![]() H2(g)+C02(g),K2 ②
H2(g)+C02(g),K2 ②
C(s)+H20(g) ![]() CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③
则K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如N0、N02、N204等。对反应N2O4(g) ![]() 2N02(g)△H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g)△H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N204、N02的量),反应速率v与时间t关系如图所示。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中N02的含量最高的一段时间是 。
查看答案和解析>>
科目:高中化学 来源:2012届山东省德州市高三上学期期末考试化学试卷 题型:填空题
(14分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=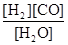 ,它所对应的化学反应为:
,它所对应的化学反应为:
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+C02(g)  2C0(g),K1 ①
2C0(g),K1 ①
CO(g)+H20(g)  H2(g)+C02(g),K2 ②
H2(g)+C02(g),K2 ②
C(s)+H20(g)  CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③
则 K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如N0、N02、N204等。对反应N2O4(g)  2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N204、N02的量),反应速率v与时间t关系如图所示。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中N02的含量最高的一段时间是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com