
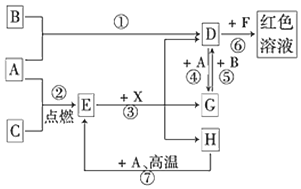
分析 A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体,则单质A应为金属,A和H高温反应生成E为黑色固体,E黑色固体和X反应生成D、G、H,其中DG之间可以实现相互转化,说明A为变价金属Fe,和C在点燃条件下生成黑色固体E为Fe3O4,C为O2,依据D+A=G说明D为含三价铁离子的化合物,F为含硫氰酸根离子的化合物,G为含Fe2+离子的化合物,单质B常温下是液态,能与Fe反应,则B为Br2,D为FeBr3,D与F得到红色溶液,则F为KSCN,由D与G之间的相互转化,可知G为FeBr2,Fe与气体C反应得到E,E与X反应得到D、G、H,H在常温下为液体,X是一种无氧强酸,可推知X为HBr,H为H2O,据此解答.
解答 解:(1)由上述分析可知,A为Fe,D为FeBr3,E为Fe3O4,X为HBr,
故答案为:FeBr3;HBr;
(2)在反应①~⑦中,①为铁和溴发生的氧化还原反应,②为铁和氧气发生的氧化还原反应,③为四氧化三铁和HBr发生的复分解反应,不是氧化还原反应,④为溴化铁和铁发生的氧化还原反应,⑤为溴化亚铁和溴发生的氧化还原反应,⑥是溴化铁和硫氰酸盐发生的络合反应,不是氧化还原反应,
故答案为:③⑥;
(3)反应⑥是氯化铁和硫氰酸盐发生的复分解反应,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,故答案为:Fe3++3SCN-=Fe(SCN)3;
(4)反应⑦是铁在水蒸气中发生的反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;该反应中符合氧化还原反应的电子守恒,氢元素化合价从+1价变化为0价,4H2O反应转移电子为 8mol,铁元素从0价变化为+$\frac{8}{3}$价,每消耗 0.3mol的A(Fe),可转移电子0.8mol即0.8NA个,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;0.8NA;
(5)D为FeBr3,D的溶液与小苏打溶液反应的离子方程式为Fe3++3HCO3-=Fe(OH)3↓+3CO2↑,D的溶液中通人少量SO2反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评 本题考查无机物推断,涉及Fe、Br元素化合物的性质与转化,需要熟练掌握元素化合物知识,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 化学反应中的能量变化主要是由化学键变化引起的 | |
| C. | 反应物的总能量与生成物的总能量一定相等 | |
| D. | 化学反应中既有物质变化又有能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
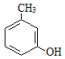 +CH3COCH2COOC2H5$→_{10℃搅拌12h}^{浓硫酸}$
+CH3COCH2COOC2H5$→_{10℃搅拌12h}^{浓硫酸}$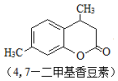 +C2H5OH+H2O
+C2H5OH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | 向浓度均为0.1mol/L的NaHCO3溶液和NaHSO3溶液中滴加几滴酚酞试剂 | 前者溶液变红,后者不变色 | NaHCO3水解,而NaHSO3不水解 |
| B | 向NaAlO2溶液中通入NH3 | 白色沉淀 | Al(OH)3不能溶解在弱碱中 |
| C | 向滴有品红的水中通入SO2 | 溶液红色褪去 | SO2具有氧化性 |
| D | 将充有NO2的密闭烧瓶放入热水中 | 烧瓶内气体颜色变深 | NO2生成N2O4的反应中,△H<0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10g 46%的乙醇水溶液中,氧原子的个数为0.4NA | |
| B. | 等物质的量的氧化钠和过氧化钠晶体中所含有的阴离子数均为NA | |
| C. | 标准状况下,22.4 L 环己烷中所含有的非极性键的数目为6NA | |
| D. | 向含有0.1mol的FeI2溶液中通入0.1mol Cl2,充分反应后转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃 名称为3,5-二甲基-4-乙基己烷 名称为3,5-二甲基-4-乙基己烷 | |
| B. | 涤纶是由对苯二甲酸(PTA)和乙二醇(EG)通过加聚反应得到的 | |
| C. | 有机物 CH3CH2CH(CH3)2 的一氯代物有 4 种 | |
| D. | 葡萄糖可以进一步水解成两分子乳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 2:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃是用于生产硅胶、木材防火剂、粘合剂的原料 | |
| B. | 可以用氢氧化钠溶液鉴别地沟油和矿物油 | |
| C. | CaCO3分解,Ba(OH)2•8H2O和NH4Cl 反应,高温下铝与氧化铁的反应都是吸热反应 | |
| D. | 淀粉、蛋白质、有机玻璃、天然橡胶都是高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com