
| A. | 仅用氨水即可鉴别NaCl、AgCl3、AgNO3 | |
| B. | 用水鉴别乙醇、甲苯、苯 | |
| C. | 用新制氢氧化铜悬浊液鉴别甲酸、乙酸、乙醛 | |
| D. | 用激光笔照射的方法鉴别硫酸铜溶液和氢氧化铁胶体 |
分析 A.AgCl3与氨水反应生成白色沉淀;
B.甲苯、苯与水分层现象相同;
C.甲酸、乙酸、乙醛分别与氢氧化铜反应的现象为:蓝色溶液和砖红色沉淀、蓝色溶液、砖红色沉淀;
D.丁达尔现象为胶体特有的性质.
解答 解:A.AgCl3与氨水反应生成白色沉淀,NaCl不反应,AgNO3与氨水先生成沉淀后溶解,现象不同,可鉴别,故A不选;
B.甲苯、苯与水分层现象相同,水不能鉴别,故B选;
C.甲酸、乙酸、乙醛分别与氢氧化铜反应的现象为:蓝色溶液和砖红色沉淀、蓝色溶液、砖红色沉淀,现象不同,可鉴别,故C不选;
D.丁达尔现象为胶体特有的性质,则用激光笔照射的方法鉴别硫酸铜溶液和氢氧化铁胶体,故D不选;
故选B.
点评 本题考查物质鉴别的实验评价,为高频考点,把握物质的性质、性质差异及反应现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 可简写为
可简写为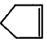 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为: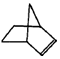
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Cl2通入氢氧化钠溶液制取消毒液:C12+2OH-═Cl-+ClO-+H2O | |
| B. | 己知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:2AlO2-+SO2+3 H2O═2 Al(OH)3↓+SO32- | |
| C. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2 Al(OH)3↓ | |
| D. | 利用酸性高锰酸钾测居室中甲醛含量反应为:4MnO4-+5HCHO+12H+═4Mn2++5CO2↑+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a可能是40,m>n | B. | a可能是40,m=n | C. | a可能是30,m>n | D. | a可能是30,m<n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com