
| A. | 物质的分离提纯方法之一为“筛分”:如胶体-渗析法提纯;悬浊液-过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” | |
| B. | 酸式滴定管,碱式滴定管、移液管都是准确量取一定体积液体的仪器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程 | |
| C. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3次的实验平均值等措施,已达到良好的实验结果 | |
| D. | 将适量植物油、酒精和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可以制得肥皂 |
分析 A.渗析中胶体不能透过半透膜,而离子可以;悬浊液中沉淀不能透过滤纸,离子、分子可以;
B.移液管不需要检查是否漏水;
C.测定中和热,保温和准确测定最高温度是关键,且利用环形玻璃搅拌棒;
D.油脂在碱性条件下水解制备肥皂.
解答 解:A.渗析中胶体不能透过半透膜,而离子可以;悬浊液中沉淀不能透过滤纸,离子、分子可以,则本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子”,故A正确;
B.移液管不需要检查是否漏水,酸式滴定管,碱式滴定管在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程,故B错误;
C.中和热的测定中,为了减少热量散失,应该使用环形玻璃棒搅拌,不能使用普通玻璃棒,故C错误;
D.油脂、NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可以制得肥皂,不需要加乙醇,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及物质的分离和提纯、皂化反应、中和热测定等,明确实验原理及物质性质是解本题关键,注意从操作的规范性及物质的性质分析评价,易错选项是D.


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:填空题
| 芝麻酱每100 g含有 蛋白质:19.2 g 脂肪:52.7 g 碳水化合物16.8 g 维生素 A:17 μg 铁:50.3 mg 硒:4 μg 含钙:相当于300 g豆腐 含铁:相当于800 g鸡蛋 (提醒:芝麻酱可引起部分婴儿过敏性皮炎) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| B. | 加水,将湿润的红色石蕊试纸放在试管口 | |
| C. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
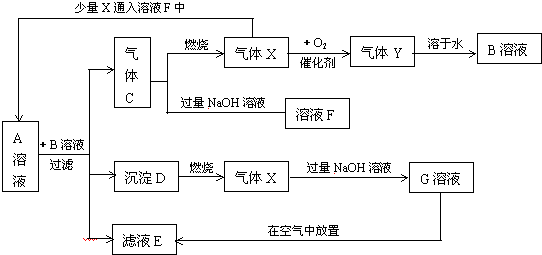
| A. | 气体C是SO2 | |
| B. | 溶液A和溶液B可能的化学反应为3Na2S+Na2SO3+4H2SO4=3S↓+H2S↑+4Na2SO4+3H2O | |
| C. | 若氧气足量气体C可以一步反应得到气体Y | |
| D. | 图中少量X通入溶液F中不涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常温下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物民其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.
短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常温下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物民其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 | |
| B. | 乙醇依次通过消去、取代、加成反应可生成乙二醇 | |
| C. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| D. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
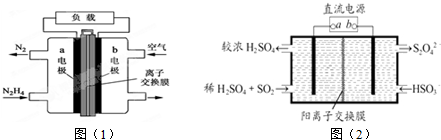
| A. | 图(1)中的a电极应与 图(2)的a相连 | |
| B. | 图(1)中a电极应的反应方程式为:N2H4+4OH--4e-═N2+4H2O | |
| C. | 用该燃料电池作为装置图(2)的直流电,吸收1 molSO2至少需要通人 0.5 mol N2H4 | |
| D. | 图(1)中OH-由阴离子交换膜从左流向右,图(2)中H+由阳离子交换膜从右流向左 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com