
【题目】如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是
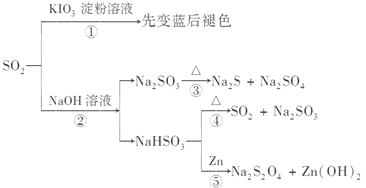
A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)俗称草酸,为无色晶体,是二元弱酸,其电离常数Ka1=5.4×10![]() ,Ka2=5.4×10
,Ka2=5.4×10![]() 。回答下列问题:
。回答下列问题:
(1)向10 mL0.1mol·L![]() H2C2O4溶液中逐滴加入0.1mol·L
H2C2O4溶液中逐滴加入0.1mol·L![]() NaOH溶液
NaOH溶液
①当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)___________10 mL(填“>”“=”或“<”)。
②随着苛性钠的加入,H+逐渐减少,当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为____________(填标号)。
A.强酸性 B.弱酸性 C.中性 D.碱性
(2)某同学设计实验测定含杂质的草酸晶体(H2C2O4·2H2O)纯度(杂质不与酸性高锰酸钾反应)。实验过程如下:称取m g草酸晶体于试管中,加水完全溶解,用c mol·L![]() KMnO4标准溶液进行滴定
KMnO4标准溶液进行滴定
①通常高锰酸钾需要酸化才能进行实验,通常用_________酸化
A.硫酸 B.盐酸 C.硝酸 D.石炭酸
②则达到滴定终点时的现象是_____________________;
③该过程中发生反应的离子方程式为___________________________;
④滴定过程中消耗V mL KMnO4标准溶液,草酸晶体纯度为_________________。
(3)医学研究表明,肾结石主要是由CaC2O4 组成的,已知Ksp(CaC2O4)=2.3×10-9,若血液经血小球过滤后,形成的尿液为200 mL,其中含有Ca2+ 0.01 g。为了不形成CaC2O4 沉淀,则C2O42-的最高浓度为______ mol·L![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是:
①________,②________,③________,④__________,⑤__________。
(2)图中现象c表明检验出的离子是________________。
(3)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(4)气体E通入试剂④发生反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl2+2I=2C1-+I2为验证Fe3+、I2氧化性的相对强弱。某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,关闭活塞a。
Ⅳ.打开活塞b,将C中的溶液滴入D中,关闭活塞b,取下D振荡、静置。
请回答下列问题:
(1)A中产生黄绿色气体,写出A中发生反应的离子方程式___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中通入氯气溶液变黄的离子方程式是;再向B中滴加KSCN溶液,溶液变红的离子方程式是___。
(4)C中的溶液滴入D中,振荡、静置,若产生现象,则说明Fe3+的氧化性强于碘单质,对应反应的离子方程式是___。有人认为这个实验设计存在缺陷,其理由是___。
(5)浸有氢氧化钠溶液的棉花作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.1 mol碳正离子(CH3+)所含的电子总数为9NA
B.离子结构示意图 既可以表示35Cl-,也可以表示37Cl-,1 mol Fe与1 mol Cl2充分反应,转移电子数为2NA
既可以表示35Cl-,也可以表示37Cl-,1 mol Fe与1 mol Cl2充分反应,转移电子数为2NA
C.标准状况下,22.4 L己烷中共价键数目为19NA
D.1 mol雄黄(As4S4),结构如图: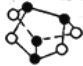 ,含有2NA个S-S键
,含有2NA个S-S键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素,如图是实验室从海藻中提取捵的部分流程:
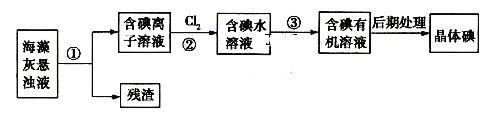
下列判断不正确的是
A.步骤①、③的操作分别是过滤、萃取分液
B.步骤②中反应的离子方程式为:![]()
C.可用淀粉溶液检验步骤②中的反应是否进行完全
D.步骤③中加入的有机溶剂可以是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸亚铁,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与FeSO4反应得富马酸亚铁。
已知:
物质名称 | 化学式 | 相对分子质量 | 电离常数(25℃) |
富马酸 | C4H4O4 | 116 | K1=9.5×10-4,K2=4.2×10-5 |
碳酸 | H2CO3 | K1=4.4×10-7,K2=4.7×10-11 | |
富马酸亚铁 | FeC4H2O4 | 170 |
i.制备富马酸亚铁:
①将富马酸置于100 mL烧杯A中,加热水搅拌
②加入Na2CO3溶液10 mL使溶液pH为6.5~6.7。并将上述溶液移至100 mL容器B中
③安装好回流装置C,加热至沸。然后通过恒压滴液漏斗D缓慢加入FeSO4溶液30 mL
④维持反应温度100℃,充分搅拌1.5小时。冷却,减压过滤,用水洗涤沉淀
⑤最后水浴干燥,得棕红(或棕)色粉末,记录产量。
请回答以下问题:
(1)该实验涉及到的主要仪器需从以下各项选择,则B为_________(填字母),C为___________(填名称);

(2)己知反应容器中反应物FeSO4和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入Na2CO3溶液调节pH的目的是_____________,若加入Na2CO3溶液过量,对实验的影响是_____________;
(3)所需FeSO4溶液应现用现配,用FeSO4·7H2O固体配置FeSO4溶液的方法为:__________;
(4)写出容器B中制备富马酸亚铁的化学方程式:___________;
(5)步骤④检验沉淀是否洗净的方法是:________________;
ii. 计算产品的产率:
(6)经测定,产品中富马酸亚铁的纯度为76.5%、以5.80 g富马酸为原料反应制得产品8.50 g,则富马酸亚铁的产率为______________%(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-硫电池具有高能量密度、续航能力强等特点。使用新型碳材料复合型硫电极的锂-硫电池工作原理示意图如图,下列说法正确的是
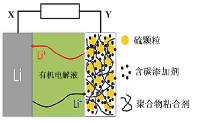
A.电池放电时,X电极发生还原反应
B.电池充电时,Y电极接电源正极
C.电池放电时,电子由锂电极经有机电解液介质流向硫电极
D.向电解液中添加Li2SO4水溶液,可增强导电性,改善性能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法不正确的是

A. δFe晶胞中含有2个铁原子,每个铁原子等距离且最近的铁原子有8个
B. 晶体的空间利用率:δFe > γFe> αFe
C. 设γFe晶胞中铁原子的半径为d,则γFe晶胞的体积是16![]() d 3
d 3
D. 已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1),δFe晶胞的密度为ρ g/cm3,则铁原子的半径r(cm)=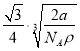
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com