
| A. | 容器中NH3的物质的量一定增加了0.30mol | |
| B. | 容器中H2O(g)的物质的量至少为0.45mol | |
| C. | NH3的平均反应速率为0.010mol/(L•s) | |
| D. | NH3、O2、NO、H2O的物质的量之比一定为4:5:4:6 |
分析 A.NO的物质的量增加了0.30mol,则氨气的我知道一定减小;
B.根据计量数关系可计算出水的物质的量变化;
C.先计算出NO的平均反应速率,然后根据计量数关系确定氨气的平均反应速率;
D.缺少初始反应物的物质的量,无法确定各物质的物质的量之比.
解答 解:A.30s后NO的物质的量增加了0.30mol,根据反应方程式可知氨气的物质的量一定减小了0.30mol,故A错误;
B.30s后NO的物质的量增加了0.30mol,则水的物质的量增加了:0.30mol×$\frac{6}{4}$=0.45mol,若原先容器中含有水,则此时水的物质的量大于0.45mol,所以容器中水的物质的量至少为0.45mol,故B正确;
C.该段时间内NO的平均反应速率为:$\frac{\frac{0.30mol}{2L}}{30s}$=0.005mol/(L•s),氨气与水水的计量数相等,则氨气的平衡反应速率与NO的反应速率相等,都是0.005mol/(L•s),故C错误;
D.没有告诉NH3、O2、NO、H2O的初始物质的量,无法计算此时NH3、O2、NO、H2O的物质的量之比,故D错误;
故选B.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡的特征及影响因素为解答关键,注意掌握化学反应速率与化学计量数之间的关系,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C2H4 | B. | C2H4和C3H4 | C. | C2H4和C2H6 | D. | C3H6和C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C-O键的极性比N-O键的极性大 | |
| B. | CO和N2互为等电子体,且N2的沸点比CO的高 | |
| C. | H2CO3、H2SiO3、H3PO4酸性越来越弱 | |
| D. | 金属K采用面心立方堆积,空间利用率为74% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消去、加成、取代 | B. | 加成、取代、水解 | C. | 取代、加成、消去 | D. | 加成、取代、消去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y、Z原子的核外最外层电子数的总和为22 | |
| B. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| C. | 有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | 上述四种元素的原子半径大小为W<X<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,用来杀菌消毒 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 碳酸氢钠热稳定性弱,用作焙制糕点的发酵粉 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
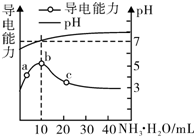 常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )
常温下,向10mL 0.1mol/L的HR溶液中逐滴滴入0.l mol/L的氨水,溶液pH及导电性变化如图.下列分析正确的是( )| A. | HR为强酸 | |
| B. | 加入10 mL 氨水时,溶液中c(NH4+)>c(R-) | |
| C. | c点溶液存在c(NH4+)<c( R-) | |
| D. | b点的离子浓度大于a点的离子浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com