
【题目】环己烯是重要的有机合成原料,常用作高辛烷值汽油稳定剂。其实验室制备流程如下:
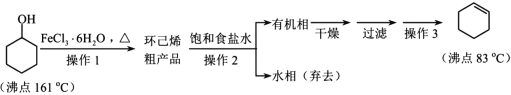
请回答下列问题:
(1)实验室用FeCl3 溶液制备 FeCl3·6H2O 的方法是__________。
(2)操作 1 的装置如图所示(加热和夹持装置已略去)。
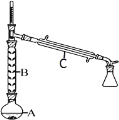
①仪器B的作用为_________。
②烧瓶A中进行的可逆反应化学方程式为_______
(3)浓硫酸也可作该反应的催化剂,选择 FeCl3·6H2O 而不用浓硫酸的原因为________(填选项)。
A.浓硫酸易使原料碳化并产生 SO2
B.FeCl3·6H2O 污染小、可循环使用,符合绿色化学理念
C.同等条件下,用 FeCl3·6H2O 比浓硫酸的平衡转化率高
(4)操作2用到的玻璃仪器是____________。
(5)环己烯含量的测定:在一定条件下,向 a g 环己烯样品中加入定量制得的b mol Br2, 与环己烯充分反应后,剩余的 Br2 与 足 量 KI 作用生成 I2 ,用 c molL-1 的 Na2S2O3标准溶液滴定,终点时消耗 Na2S2O3 标准溶液 v ml(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
①![]() +Br2→
+Br2→![]()
② Br2+ KI=I2 + 2KBr
③ I2 + 2Na2S2O3=2 NaI+ Na2S4O6
滴定所用指示剂为_____________________ ;样品中环己烯的质量分数为_________________(用字母表示)。
【答案】在HCl气流下蒸发溶液 减少环己醇蒸出、冷凝回流 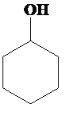
![]()
 +H2O AB 分液漏斗和烧杯 淀粉溶液
+H2O AB 分液漏斗和烧杯 淀粉溶液 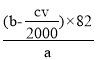
【解析】
(1)FeCl3在水中易发生水解反应,故在制备FeCl3·H2O时需要在HCl气流下蒸发溶液;
(2)①仪器B为冷凝管,其作用为减少环己醇蒸出、冷凝回流;
②化学方程式为
![]()
 +H2O;
+H2O;
(3)烧瓶中进行的可逆反应是环己醇在氯化铁作用下转化为环己烯。若用浓硫酸作反应的催化剂,由于浓硫酸的强氧化性,易使原料碳化并产生二氧化硫,A正确;使用氯化铁晶体污染小,而选择浓硫酸时,反应后有大量硫酸需要处理,不易回收利用,B正确;催化剂的使用不影响平衡转化率,C错误;故选AB;
(4)操作2用到的玻璃仪器有分液漏斗和烧杯;
(5)用硫代硫酸钠滴定I2时,需要选择合适的指示剂,应选用淀粉溶液做指示剂,当I2与硫代硫酸钠溶液完全反应后,溶液中无I2,溶液颜色由蓝色变为无色;根据反应②③可得过量的Br2和Na2S2O3的关系式为Br2~2Na2S2O3,所以n(Br2)=5cv![]() 10-4mol,所以与环己烯反应的n(Br2)=(b-5cv
10-4mol,所以与环己烯反应的n(Br2)=(b-5cv![]() 10-4)mol,即n(环己烯)= (b-5cv
10-4)mol,即n(环己烯)= (b-5cv![]() 10-4)mol。故样品中环己烯的质量分数为(b-5cv
10-4)mol。故样品中环己烯的质量分数为(b-5cv![]() 10-4)
10-4)![]() 82g
82g![]() ag=
ag=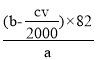 。
。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述中,正确的是( )
A.有单质参加的反应一定是氧化还原反应
B.燃烧反应必须有氧气作氧化剂
C.2Fe+3Cl2![]() 2FeCl3; Fe+S
2FeCl3; Fe+S![]() FeS 由此可以判断氧化性:Cl2>S
FeS 由此可以判断氧化性:Cl2>S
D.Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子,因此还原性Al>Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴酸镉[Cd(BrO3)2]常用做分析试剂、生产荧光粉等。以镉铁矿(成分为 CdO2、Fe2O3、FeO 及少量的Al2O3 和SiO2)为原料制备[Cd(BrO3)2]的工艺流程如下:

已知 Cd(SO4)2 溶于水,回答下列问题:
(1)为提高镉的浸取率,酸浸时可采取的措施有 ____________(任写两种即可)。
(2)还原镉时,产生能使澄清石灰水变浑浊的气体,发生的离子反应方程式为 ________。
(3)加入H2O2 溶液的目的是_________。
(4)滤渣2 的主要成分为_______________ (填化学式);为检验滤液中是否含有 Fe3+离子,可选用的化学试剂是__________________ 。
(5)实际工业生产中,有时还采用阳离子交换树脂法来测定沉镉后溶液中 Cd2+的含量, 其原理是:Cd2++ 2NaR=2Na++ CdR2 ,其中 NaR 为阳离子交换树脂。常温下,将沉镉后的溶液(此时溶液 pH=6)经过阳离子交换树脂后,测得溶液中的 Na+比交换前增加了 0.0552 g/L,则该条件下Cd(OH)2 的 Ksp 值 为___________。
(6)已知镉铁矿中 CdO2 的含量为 72 %,整个流程中镉元素的损耗率为 10 %,则 2t 该镉铁矿可制得 Cd(BrO3)2(摩尔质量为 368 g/mol)质量为 ________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与3.36LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·L-1NaOH溶液至 Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60mLB.120mLC.240mLD.360mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为实验室常用装置。回答下列问题:
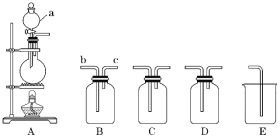
(1)仪器a的名称为____。
(2)利用二氧化锰与浓盐酸反应制备并收集Cl2时,依次连接装置 A、B、C、D、E并加入适当的 试剂。装置B中饱和食盐水的作用是____;利用装置C干燥Cl2,选用的试剂是____;装置E的作用是____。
(3)利用铜和稀硝酸反应制备并收集NO时,连接装置A、B、E并加入适 当的试剂。A中反应的离子方程式为____,A中导气管应连接B的___(填“b”或“c”)端。实验过程中观察到A中出现了红棕色,但收集的气体为无色,原因是____(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2KClO3 + H2C2O4 + H2SO4= K2SO4 + 2ClO2 + 2CO2 + 2H2O。
(1)用单线桥法表示该反应的电子转移的方向和数目_______。
(2)该反应的氧化剂是____,还原剂是_____,氧化产物是_____,还原产物是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求答题
(一)现有下列七种物质:①铝 ②蔗糖 ③CO2 ④H2SO4 ⑤Ba(OH)2 ⑥红褐色的氢氧化铁胶体 ⑦HCl ⑧冰水混合物 ⑨碳酸钙 ⑩CuSO4·5H2O。
(1)上述物质中属于电解质的有__________(填序号)。
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是________________________。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH-=H2O,则该反应的化学方程式为______________________________。
(二)(1)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积是448 mL,则氧化物的摩尔质量为_______,R的相对原子质量为__________。
(2)在标准状况下,w L氮气含有x个N2分子,则阿伏加德罗常数为____________(用w,x表示)。
(3)过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的BaCl2溶液;②加入稍过量的NaOH溶液;③加入稍过量的Na2CO3溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是________(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图装置中,加热试管内的白色固体A(A的焰色反应为黄色),生成白色固体B并放出气体C和D,这些气体通过甲瓶的浓硫酸后,C被吸收;D进入乙瓶跟另一淡黄色固体E反应生成白色固体B和气体F;丙瓶中的NaOH溶液用来吸收剩余的气体D。
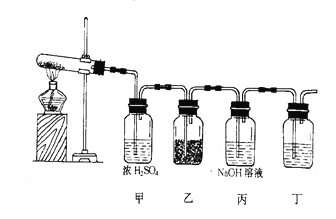
(1)写出各物质的化学式:
A______; B_______; C________; D______; E_______; F___________。
(2)写出试管中及丙瓶中反应的化学方程式:_______________;__________________。
(3)等物质的量A、B分别与足量的盐酸反应生成气体的体积________(填“一样多”、“前者多”、“后者多”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
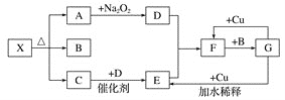
(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com