
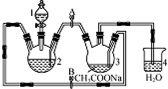
 醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂,实验室中以锌粒,三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒,已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂,实验室中以锌粒,三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒,已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:分析 (1)根据仪器结构特征,可知仪器1为分液漏斗;
(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出;
(3)利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合;
(4)过量的锌与CrCl3充分反应得到CrCl2;
(5)CrCl3为0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,根据CrCl2计算[Cr(CH3COO)2]2•2H2O 的理论产量,进而计算其产率;
(6)向废液中通入足量的空气或氧气,将Cr2+氧化为Cr3+,根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.3×10-31计算溶液中c(OH-),再结合水的离子积计算c(H+),溶液pH=-lgc(H+).
解答 解:(1)根据仪器结构特征,可知仪器1为分液漏斗,
故答案为:分液漏斗;
(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化,故先加盐酸一段时间后再加三氯化铬溶液,
故答案为:C;让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化;
(3)利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合,应关闭阀门B,打开阀门A,
故答案为:B;A;
(4)锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是:过量的锌与CrCl3充分反应得到CrCl2,
故答案为:过量的锌与CrCl3充分反应得到CrCl2;
(5)CrCl3为$\frac{9.51g}{158.5g/mol}$=0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,则得到[Cr(CH3COO)2]2•2H2O为0.06mol×$\frac{1}{2}$×376g/mol=11.28g,所得产品的产率为 $\frac{9.4g}{11.28g}$
×100%=83.3%,
故答案为:83.3%;
(6)向废液中通入足量的空气或氧气,将Cr2+氧化为Cr3+,铬的离子沉淀完全时,浓度应小于10-5mol/L,根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.3×10-31,此时溶液中c(OH-)=4×10-9,溶液pH=-lgc(H+)=-lg$\frac{10{\;}^{-14}}{4×10{\;}^{-9}}$=5.6,
故答案为:空气或氧气;5.6.
点评 本题考查物质制备实验,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等,注意对题目信息的应用,有利于培养学生分析能力、实验能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 将Al条投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、Cu、Zn原子最外层电子数依次增多 | |
| B. | N、O、F元素最高正化合价依次升高 | |
| C. | P、S、Cl第一电离能依次增大 | |
| D. | Na、K、Rb的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 类别 组合 | 酸性 氧化物 | 碱性 氧化物 | 电解质 | 强电解质 | 高分子 物质 |
| A | CO2 | CuO | 氨气 | NH3•H2O | 葡萄糖 |
| B | SO3 | Na2O | 稀硫酸 | NaOH | 果糖 |
| C | SO2 | CaO | 冰醋酸 | KOH | 纤维素 |
| D | N2O5 | Na2O2 | α-丙氨酸 | Cu(OH)2 | 聚乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com