

分析 (1)10电子微粒A、B反应得到两种10电子微粒,应是铵根离子与氢氧根离子反应得到氨气与水,而C、B都能与氢离子反应,可推知A为NH4+,B为OH-,C为NH3,D为H2O;
(2)如果A、C均是18电子的粒子,B、D是10电子粒子,结合转化关系,可推断:A为H2S(或HS-),B为OH-,C为HS-或S2-,D为H2O.
解答 解:(1)10电子微粒A、B反应得到两种10电子微粒,应是铵根离子与氢氧根离子反应得到氨气与水,而C、B都能与氢离子反应,可推知A为NH4+,B为OH-,C为NH3,D为H2O,
故答案为:NH4+;H2O;
(2)如果A、C均是18电子的粒子,B、D是10电子粒子,结合转化关系,可推断:A为H2S(或HS-),B为OH-,C为HS-或S2-,D为H2O,A与B在溶液中反应的离子方程式为:HS-+OH-═S2-+H2O等,根据离子方程式,可以判断结合质子的能力大小是OH->S2-,
故答案为:HS-+OH-═S2-+H2O;OH->S2-.
点评 本题考查无机物推断,熟练掌握常见10电子、18电子微粒的结构和性质应用,难度中等.


科目:高中化学 来源: 题型:实验题
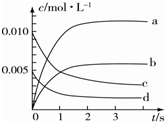 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表所示:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表所示:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g H2 和10g O2 | B. | 5.6L N2(标准状况下)和11gCO2 | ||
| C. | 9克H2O和11.2L O2 | D. | 224mL H2(标准状况下)和0.1mol N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1 | A | |||||||||||||||||
| 2 | B | |||||||||||||||||
| 3 | C | D | E | F | G | H | I | |||||||||||
| 4 | J | K | ||||||||||||||||
| 5 | ||||||||||||||||||
| 6 | ||||||||||||||||||
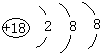 .
.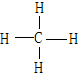 ;它的空间构型是正四面体.
;它的空间构型是正四面体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
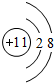 .
.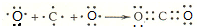 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体中含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
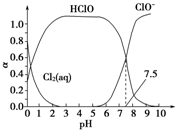 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:| A. | 由图象可知:Ka=10-7.5 | |
| B. | 在氯处理水体系中,c(HClO)+c(ClO-)>c(H+)-c(OH-) | |
| C. | 用氯处理饮用水时,杀菌效果最佳pH范围为3~6 | |
| D. | 往氯气-氯水体系中加少量碳酸钙,可提高体系漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2C=O+HCN→(CH3)2C(OH)CN | B. | CH3CH2OH→CH2=CH2↑+H2O | ||
| C. | 2CH3CHO+O2→2CH3COOH | D. | CHCl3+HF→CHFCl2+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Al/MnO4-电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示.已知电池总反应为Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列说法正确的是( )
Al/MnO4-电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示.已知电池总反应为Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列说法正确的是( )| A. | 电池工作时,K+向负极移动 | |
| B. | 电池工作时,Al电极周围溶液pH增大 | |
| C. | 电池工作时,电子由Al经溶液流向Ni | |
| D. | 正极反应为MnO4-+2H2O+3e-═MnO2+4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com