
| A. | 原混合溶液中c(K+)为2 mol•L-1 | |
| B. | 上述电解过程中共转移2 mol电子 | |
| C. | 向电解后得到的体系中加1molCu2(OH)2CO3固体,可使溶液恢复至电解前的浓度 | |
| D. | 电解后溶液中c(H+)为2 mol•L-1 |
分析 石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),则阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,结合电子守恒及物质的量浓度的计算来解答.
解答 解:石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,
阳极发生电极反应为:4OH--4e-═O2↑+2H2O,
4mol4mol 1mol
阳极生成1mol氧气转移4mol电子,电解过程中转移电子相等,所以阴极转移4mol电子
阴极发生的电极反应为:2H++2e-═H2↑
1mol 2mol 1mol
生成1mol氢气转移2mol电子,所以铜离子得电子生成Cu时得到2mol电子,
Cu2++2e-═Cu
2mol 2mol 1mol
根据关系式知,生成n(Cu)=1mol,
A.所以原溶液中c(Cu2+)=$\frac{1mol}{0.5L}$=2mol/L,根据电荷守恒得c(K+)=c(NO3-)-2c(Cu2+)=(6-4)mol/L=2mol/L,故A正确;
B.根据以上分析知,共转移4mol电子,故B错误;
C.根据以上分析知,析出的物质相当于1molCuO、1molH2O,Cu2(OH)2CO3可以改写为2CuO.H2O.CO2,根据析出什么加入什么原则知,加入1mol碱式碳酸铜不能使溶液恢复原状,故C错误;
D.电解硝酸铜时阳极附近生成氢离子,电解硝酸钾时实际上是电解水,所以阴极析出Cu时,生成n(H+)=n(OH-)=2mol,电解后溶液中c(H+)=$\frac{2mol}{0.5L}$=4mol/L,故D错误;
故选A.
点评 本题考查电解原理,为高频考点,侧重考查学生分析计算能力,明确电解过程中各个阶段发生的反应是解本题关键,注意转移电子守恒的应用,易错选项是C.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
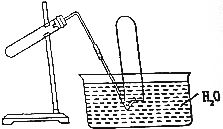
| A. | MnO2与H2O2溶液反应制O2 | B. | Cu与稀硝酸反应制NO | ||
| C. | 加热氯化铵与消石灰制备NH3 | D. | 用Cu于浓硝酸反应制得NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时PbO2为正极,反应的离子方程式为:PbO2+4H++2e-+SO42-═PbSO4+2H2O | |
| B. | 充电时Pb电极为阴极,反应的离子方程式为:PbSO4+2e-═Pb+SO42- | |
| C. | 放电时电解质溶液密度不断减小,可根据电解液密度来判断是否需要充电 | |
| D. | 充电时可直接使用交流电源,不需要充电器也可充入 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | E(5s)>E(4f)>E(4s)>E(3d) | B. | E(4f)>E(3d)>E(4s)>E(3p) | C. | E(5d)>E(4d)>E(3d)>E(2d) | D. | E(5s)>E(4s)>E(4f)>E(3d) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜与氢氧化钡反应:Ba2++SO42-═BaSO4↓ | |
| B. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| C. | AlCl3溶液中滴加过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 金属钠与水反应:2Na+2 H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
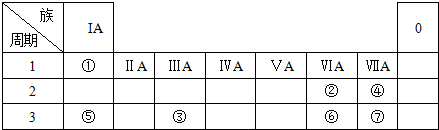
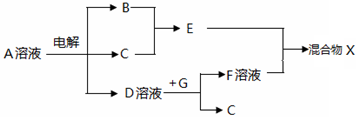
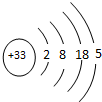 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com