
有机物A的分子式为C11H16 ,它不能因反应而使溴水褪色,但能使酸性KMnO4溶液褪色,经测定数据表明,分子中除含苯环外不再含有其他环状结构,且苯环上只有一个侧链,符合此条件的烃的结构有
A.5种 B.6种 C.7种 D.8种
科目:高中化学 来源:2013-2014河南省周口市高二下学期6月联考化学试卷(解析版) 题型:选择题
分析下表中各项的排布规律,有机物M是按此规律排布的第19项,其中能发生银镜反应又属于 酯类的M的同分异构体(不考虑立体异构)有

查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期5月联考化学试卷(解析版) 题型:选择题
如将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为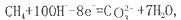 ,下列叙述正确的是
,下列叙述正确的是
A.通入甲烷的一极为正极
B.通入氧气的一极发生氧化反应
C.该电池总反应为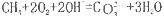
D.该电池在工作时,溶液中的阴离子向正极移动
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高二期终质量评估化学试卷(解析版) 题型:填空题
(4分) 甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过下列转化关系可由甲制取丁: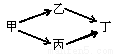
若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙。回答下列问题:
(1)乙的分子结构中一定含有的官能团是 (填名称);丙的分子结构中一定含有的官能团的电子式为 。
(2)乙、丙的相对分子质量之差为 (填一个数字)的整数倍。
(3)满足上述转化关系的甲、乙、丙、丁中,相对分子质量最小的甲的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高二期终质量评估化学试卷(解析版) 题型:选择题
氨甲环酸和氨甲苯酸是临床上常用的止血药,其结构如下图:
 、
、
下列说法错误的是
A.氨甲环酸、氨甲苯酸都既能溶于盐酸,又能溶于NaOH溶液
B.氨甲环酸、氨甲苯酸都能发生取代、氧化、缩聚等反应
C.氨甲环酸、氨甲苯酸中各有5种不同的氢原子
D.氨甲苯酸和苯丙氨酸互为同系物
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高二期终质量评估化学试卷(解析版) 题型:选择题
环境问题越来越成为全球关注的热点。下列有关环境方面的说法不正确的是
A.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量
B.采用天然石材装修家居,可减轻室内甲醛污染但会导致一定量的放射性物质的污染
C.汽油中添加含铅化合物Pb(C2H5)4,可提高汽油的抗爆震性能,有利于改善大气环境
D.PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:选择题
现有一包铝热剂是铝粉和氧化铁(Fe2O3)粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(假定反应前后溶液的体积不变):
①向其中一份固体中加入100 mL 2.0mol?L-1的NaOH溶液,加热使其充分反应后过滤,测得溶液中的c(OH-)=1mol?L-1
②向另一份固体中加入100 mL 4.0 mol?L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且c(H+)=0.1mol?L-1则产生的气体的体积(标准状况)为 ( )
A.2.856L B.2.448L C.2.688L D.2.352L
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省六市毕业班第二次联合调研检测理综化学试卷(解析版) 题型:填空题
【化学--选修2化学与技术】(15分)
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
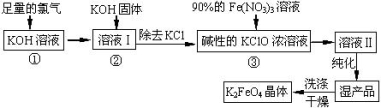
已知:2KOH + Cl2 ═ KCl + KClO + H2O(条件:温度较低)
6KOH + 3Cl2 ═ 5KCl + KClO3 + 3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺反应①应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体( 该溶液的密度为1.47 g/mL),它
的物质的量浓度为 ;
(5)在“溶液I”中加KOH固体的目的是 :
A.与 “溶液I” 中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,还会有副产品 (写化学式),它们都是重要的化工 产 品,具体说出其中一种物质的用途 (答1点即可); 则反应③中发生的离子反应方程式为 。
(7)如何判断K2FeO4晶体已经洗涤干净 。
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省邯郸市高二7月调研考试化学试卷(解析版) 题型:选择题
下列关于原电池的叙述中,正确的是( )
A.把电能转化为化学能,使溶液发生氧化还原反应
B.电子从活泼金属流向不活泼金属,不活泼金属为负极
C.外电路中电子从负极流向正极
D.正极发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com