
【题目】下列物质的保存方法不正确的是
A.新制氯水应密封保存B.盛液溴的试剂瓶常加少量水
C.少量的金属钠应保存在煤油中D.固态碘放在棕色细口瓶中
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】二氧化碳是导致温室效应的主要气体,其对应的水溶液碳酸是可乐饮料的主要成分之一。回答下列问题:
(1)下列事实中,能证明碳酸是弱酸的是________.
A.碳酸不稳定,易分解为二氧化碳和水
B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍
C.相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液
D.常温下,5.0×10-6mol/L的碳酸溶液pH值为6
(2)煤的燃烧也是导致温室效应的原因之一,其燃烧有下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH=Q1kJ/mol
途径II:先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH=Q2kJ/mol;再燃烧水煤气:CO(g)+1/2O2(g)=CO2(g) ΔH=Q3kJ/mol;H2(g)+1/2O2(g)=H2O(g) ΔH=Q4kJ/mol则Q1、Q2、Q3、Q4的数学关系式是___________________________________;
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol/L。
①向饱和碳酸溶液中分别加入下列物质,能使碳酸的第一步电离平衡向右移动的是_________
A.HCl气体 B.NaOH固体 C.Na单质 D.苯酚钠溶液
②若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K1=_______。(已知:10-5.6=2.5×10-6,保留一位小数);
HCO3-+H+的平衡常数K1=_______。(已知:10-5.6=2.5×10-6,保留一位小数);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒.
(1)配制220mL0.05mol/L的过氧乙酸溶液,需使用的仪器有:烧杯、量筒、玻璃棒及__________________、____________________;
(2)配制过程中,可能引起浓度偏高的操作有__________________
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.转移溶液时,不慎有少量溶液洒在容量瓶外
C.定容时,俯视容量瓶刻度线进行定容
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线
(3)过氧乙酸半小时内会完全分解成乙酸(CH3COOH)和一种常见的气体单质,检验该气体单质的实验方法是_____________________________.
(4)如果生产过氧乙酸的原料CH3COONa中混有了SO42﹣,要想除掉SO42﹣请选择下列试剂按照加入先后顺序填空__________________________________________(试剂不必选完,填序号即可)
①盐酸;②醋酸钡溶液;③氯化钡溶液;④醋酸;⑤碳酸钠溶液;⑥NaHCO3溶液.
(5)制取过氧乙酸反应原理为:H2O2+CH3COOH![]() CH3COOOH(过氧乙酸)+H2O,现称取5.0g用上述方法制取的过氧乙酸试样(液体),稀释至100mL备用.取上述稀释后过氧乙酸试样5.0mL,用0.01mol/L KMnO4溶液以除去其中的H2O2,随即加入10% KI溶液10 mL,摇匀(化学反应方程式为CH3COOOH+2KI=CH3COOK+I2+KOH)再将0.05mol/L Na2S2O3标准溶液加入到上述混合溶液中(化学反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6),消耗Na2S2O3标准溶液的总体积为20mL.通过计算确定原试样中过氧乙酸的质量分数为____________________.
CH3COOOH(过氧乙酸)+H2O,现称取5.0g用上述方法制取的过氧乙酸试样(液体),稀释至100mL备用.取上述稀释后过氧乙酸试样5.0mL,用0.01mol/L KMnO4溶液以除去其中的H2O2,随即加入10% KI溶液10 mL,摇匀(化学反应方程式为CH3COOOH+2KI=CH3COOK+I2+KOH)再将0.05mol/L Na2S2O3标准溶液加入到上述混合溶液中(化学反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6),消耗Na2S2O3标准溶液的总体积为20mL.通过计算确定原试样中过氧乙酸的质量分数为____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度和压强相同时,在体积相同的两个密闭容器甲和乙,甲中充满O2气体,乙中充满O2和O3的混合气体,下列说法正确的是
A. 两容器中气体的质量相等 B. 两容器中气体的分子数目相等
C. 两容器中气体的氧原子数目相等 D. 两容器中气体的密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.除0族元素外,短周期元素的最高正化合价都等于该元素的族序数
B.除第1周期外,其他周期均含有18种元素
C.副族元素中不含非金属元素
D.碱金属元素是指第ⅠA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度和有催化剂条件下,恒容密闭容器中发生反应N2+3H2 2NH3,下列说法正确的是( )
t/min | 0 | 5 | 10 | 15 | 20 |
c(NH3)/(mol·L-1) | 0 | 1.00 | 1.60 | 1.80 | 1.80 |
A. 0~10min内,v(NH3)=0.16mol·L-1·min-1 B. 0~10min内,v(N2)=0.18mol·L-1·min-1
C. 0~10min内,v(N2)=0.16mol·L-1·min-1 D. 15~20min内,反应v(N2)正= v(N2)逆=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
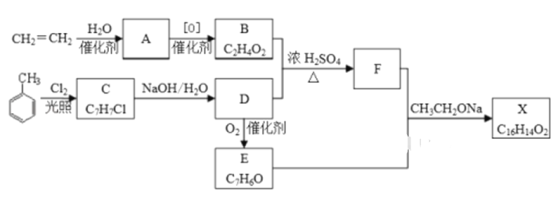
已知:RX![]() ROH;RCHO+CH3COOR′
ROH;RCHO+CH3COOR′![]() RCH=CHCOOR′
RCH=CHCOOR′
请回答:
(1)C 的结构简式________________ ,A中官能团的名称是__________
(2)B+D→F的化学方程式___________________________,其反应类型为_____________
(3)X的结构简式___________________
(4)D→E的化学方程式____________________________________
(5)F有多种同分异构体,符合下列条件的同分异构体数目有______种,请写出其中一种同分异构体的结构简式________
①是苯的二元取代物
②能发生水解及银镜反应
③核磁共振氢谱有5个吸收峰,峰面积之比为3:2:2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碘食盐中的碘是以碘酸钾(KIO3)形式存在的。已知在酸性溶液中IO3-和I-发生下列反应IO3-+5I-+6H+=3I2+3H2O。现有下列物质 ①稀硫酸;②pH试纸;③淀粉碘化钾溶液;④淀粉溶液。利用上述反应,可用来检验含碘食盐中含有IO3-的是
A.①③B.②③C.①④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)-6e-=CO2(g)+6H+(aq)
D.O2(g)+2H2O(1)+4e-=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com