
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
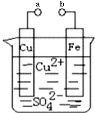
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铁片上发生的反应为:Fe-2e-=Fe2+
C. a和b用导线连接时电子从Cu片流向铁片
D. a和b用导线连接时,Cu2+向铜电极移动
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】已知C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,X在周期表中原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板。各物质之间的转化关系如图,部分生成物省略。

请回答下列问题:
(1)写出Z在周期表中的位置____,D的结构式____。
(2)写出A的化学式____。
(3)写出反应①的离子方程式____。
(4)为了获得氯化铜晶体,需要将B溶液在HCl氛围中蒸发结晶,原因是____。
(5)将F溶于稀硝酸,溶液变成蓝色,并放出无色气体。写出该反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关下图中有机物的说法不正确的是
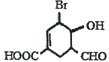
A. 该有机物的分子式为C8H9O4Br
B. 1mol该有机物最多可以与3molH2反应
C. 能发生酯化反应、水解反应、银镜反应和缩聚反应
D. 1mol该有机物与NaOH溶液反应时,最多消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氢元素可形成种类繁多的烃类物质。
(1)如图表示某些烃分子的模型:
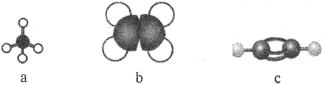
①写出a分子的空间构型:_____。
②c分子中的一个氢原子被苯基取代后的物质共直线的原子最多有____个。
③取等质量的上述三种烃充分燃烧,耗氧量最大的是___(填名称)。
④25℃和101kPa时,取a、b和c组成的混合烃32 mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了56 mL,原混合烃中c的体积分数为____。
(2)某烯烃的结构简式如图所示:![]()
①用系统命名法对该烃与H2的加成产物命名:____,该加成产物的十氯取代物有______种。
②该烯烃可以加聚生成高分子,写出该高聚物的结构简式____。该烯烃还能与乙烯以1:1比例反应形成一种环状化合物,请写出该环状化合物的键线式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如右图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是
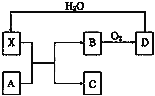
A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,C溶于水得到的酸的酸性比D溶于水得到的酸的酸性强
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)与16gO2所含原子总数相同的NH3标准状况下体积是________L;
(2)已知2L Al2(SO4)3溶液中c(Al3+)=3mol/L,它与3L__________mol/LNa2SO4中SO42-的物质的量浓度相等。
(3)同温同压下:同体积的NH3和H2S气体的质量比为_____________;同质量的NH3和H2S气体的体积比为___________,其中含有的氢的原子个数比为________;若NH3和H2S中的氢原子数相等,它们的体积比为____________。
(4)在标准状况下,8.96L的CH4和CO的混合气体,混合气体对氢气相对密度是9.5,则混合气体中CH4的体积为____________,CH4和CO原子个数比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置设计与对应结论正确的是( )
选项 | A | B | C | D |
装置 |
|
|
|
|
结论 | 能证明Al(OH)3不溶于氨水 | 能证明非金属性:Cl>C>Si | 验证铁发生析氢腐蚀 | 洗气瓶中产生的白色沉淀是BaSO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用太阳能分解水制氢,若光解0.02 mol水,下列说法正确的是
A.可生成H2的质量为0.02g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224 L(标准情况)
D.生成H2的量理论上等于0.48 g Mg与足量稀盐酸反应产生H2的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒具有众多优良的性能,用途十分广泛,有金属“维生素”之称。完成下列填空:
(1)将废钒催化剂(主要成分 V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性,溶液中含 VO2+、K+、SO42-等离子。写出该反应的化学方程式:____________。
(2)向上述所得溶液中加入 KClO3 溶液,充分反应后,溶液中新增加了 VO2+、Cl-。写出并配平该反应的离子方程式,并标出电子转移的数目和方向_____。
(3)已知V2O5 能和盐酸反应生成氯气和VO2+,请再写一个离子方程式:________,说明还原性:SO32->Cl->VO2+。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com