
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
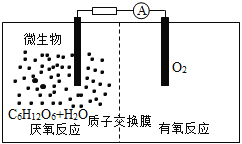
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
【答案】A
【解析】
A.根据图象,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O,因此CO2在负极产生,故A错误;
B.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池,有电流产生,所以微生物促进了反应中电子的转移,故B正确;
C.通过原电池的电极反应可知,负极区产生了H+,根据原电池中阳离子向正极移动,可知质子(H+)通过交换膜从负极区移向正极区,故C正确;
D.该反应属于燃料电池,燃料电池的电池反应式和燃烧反应式相同,则电池反应式为C6H12O6+6O2=6CO2+6H2O,故D正确;
故选A。


科目:高中化学 来源: 题型:
【题目】下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键。示例:(图中F2)根据各图表示的结构特点,下列有关叙述正确的是( )

A. 上述结构图中共出现6种元素 B. 甲、乙、丙为非极性分子,丁为极性分子
C. 甲与丁可以发生化合反应生成离子化合物 D. 向CaCl2溶液中通入丙有白色沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有2.32 g白色沉淀,在所得的浊液中逐滴加入1 mol·L1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如下图所示,试回答:
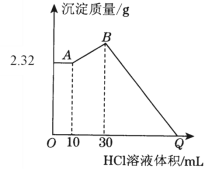
(1)B点的沉淀物的化学式为__________;写出A→B段发生反应的化学方程式_____________________________。
(2)原混合物中MgCl2的质量是________g,AlCl3的质量是________g。
(3)Q点HCl溶液加入量是________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VIA族的氧,硫,硒(Se),碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______。
![]()
(2)Se原子序数为______,其核外M层电子的排布式为______。
(3)H2Se的酸性比H2S__________(填“强”或“弱”)。气态SeO3分子的立体构型为______,SO32-离子的立体构型为______。
(4)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:__________。
②H2SeO4比H2SeO3酸性强的原因:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四川北川盛产蔷薇科植物。蔷薇科植物中含有一种芳香醛(用E表示),在染料工业和食品工业上有着广泛的用途,下面是它的一种合成路线。![]()
其中0 . l mol有机物A的质量是 12g ,在足量的氧气中充分燃烧后生成0.8mol CO2和 7.2gH2O; D 能使溴的四氯化碳溶液褪色, D 分子与 C 分子具有相同的碳原子数;F继续被氧化生成G,G 的相对分子质量为 90 。
已知:①CH3-CHO![]()
②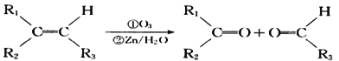
回答下列问题:
(1)A 的结构简式为__________________。
(2)A~G中能发生酯化反应的有机物有:_________(填字母序号)。
(3)C在浓硫酸加热的条件下时,分子内脱水除生成D外还可以生成另一种有机物,写出该反应的方程式:___________________;该反应类型_________。
(4)C 的同分异构体有多种,其中符合下列要求的有机物有多种。
①能与3 mol NaOH溶液反应;
②苯环上的一卤代物只有一种。
写出所有满足条件有机物的结构简式______________________________。
(5)C与4-甲基-2,3-戊二醇两分子之间1:1发生取代反应,生成的有机物有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室所用少量氯气是用下列方法制取的:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,试回答下列问题:
Cl2↑+MnCl2+2H2O,试回答下列问题:
(1)该反应中氧化剂与还原剂的物质的量比为:__。
(2)写出该反应的离子方程式:___。
(3)当有0.2mol电子转移时,生成标准状况下Cl2的体积是___L。
(4)若用足量二氧化锰与50ml36.5%1.2g/ml浓盐酸反应,制得的Cl2在标准状况下总小于3.36L,原因可能是①__,②__。
(5)检验氯气是否收集满的方法是用___试纸靠近集气瓶口,若试纸变蓝证明氯气已收集满。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按所给的要求,回答下列问题:
(1)BC13和NC13中心原子的杂化方式分别为______和____。第一电离能介于B、N之间的第二周期元素有______种。
(2)F-、K+和Fe3+三种离子组成的化合物K3FeF6,其中化学键的类型有______;该化合物中存在一个复杂的离子该离子的化学式为______,作配位体的原子是______;
(3)HCHO分子中既含σ 键又含π键______(填“正确”或“错误”) 。
(4)下列物质变化,只与范德华力有关的是(______)
A 干冰升华 B 乙醇汽化 C 乙醇与丙酮混溶 D 氯化钠溶于水 E 碘溶于四氯化碳 F 石英熔融
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
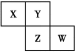
A.X的简单氢化物比Y的稳定
B.X、Y、Z、W形成的单质都是分子晶体
C.Y、Z、W的原子半径大小为W>Z>Y
D.W的最高价氧化物对应水化物的酸性比Z的弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com