
| A、活化分子能量明显增加 |
| B、增加了活化分子的百分数 |
| C、降低了反应所需的能量 |
| D、改变了反应物的本身性质 |
科目:高中化学 来源: 题型:
 一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:mA(s)+nB(g)?pC(g)+q(D)g.达到平衡后,测得B的浓度为0.5mol/L.保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L.当其条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是( )
一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:mA(s)+nB(g)?pC(g)+q(D)g.达到平衡后,测得B的浓度为0.5mol/L.保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L.当其条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是( )| A、容积扩大到原来的两倍,平衡向逆反应方向移动 |
| B、化学方程式中n>p+q |
| C、达到平衡后,若升高温度,平衡向逆反应方向移动 |
| D、达到平衡后,增加A的量,有利于提高B的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M
原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M查看答案和解析>>
科目:高中化学 来源: 题型:
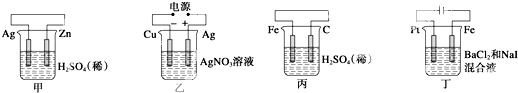
| A、甲中负极反应式为2H++2e-═H2↑ |
| B、乙中阳极反应式为Ag++e-═Ag |
| C、丙中H+向碳棒方向移动 |
| D、丁中电解开始时阳极产生黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150ml 1 mol?L-1氯化钠溶液 |
| B、75ml 2 mol?L-1氯化镁溶液 |
| C、50ml 3mol?L-1氯化钾溶液 |
| D、200ml 1.5 mol?L-1氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用规格为100 mL筒量取4 mL的液体 |
| B、把粉末状药品直接送入试管的底部 |
| C、过滤时玻璃棒要靠在三层的滤纸上 |
| D、如果没有试管夹,可以临时手持试管给固体或液体加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com