
·ÖĪö n£ØCl2£©=$\frac{33.6L}{22.4L/mol}$=1.5mol£¬ÓÉ·“Ó¦MnO2+4HCl £ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+Cl2”ü+2H2OæÉÖŖ£¬HClŅ»°ė×÷Ėį”¢Ņ»°ė×÷»¹Ō¼Į£¬½įŗĻ·“Ó¦¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©n£ØCl2£©=$\frac{33.6L}{22.4L/mol}$=1.5mol£¬ÓÉ·“Ó¦æÉÖŖ£¬²Ī¼Ó·“Ó¦µÄHClĪŖ1.5mol”Į4=6mol£¬
“š£ŗ²Ī¼Ó·“Ó¦µÄHClµÄĪļÖŹµÄĮæĪŖ6mol£»
£Ø2£©ÓÉ·“Ó¦æÉÖŖ£¬n£ØMnO2£©=n£ØCl2£©=1.5mol£¬ŌņČķĆĢæóŹÆÖŠMnO2µÄÖŹĮæ·ÖŹżĪŖ$\frac{1.5mol”Į87g/mol}{150g}$”Į100%=87%£¬
“š£ŗČķĆĢæóŹÆÖŠMnO2µÄÖŹĮæ·ÖŹżĪŖ87%£»
£Ø3£©·“Ó¦ÖŠHClŅ»°ė×÷Ėį”¢Ņ»°ė×÷»¹Ō¼Į£¬Ōņ»ÆŗĻ¼ŪøıäµÄĀČŌŖĖŲµÄÖŹĮæĪŖ1.5mol”Į2”Į35.5g/mol=106.5 g£¬
“š£ŗ»ÆŗĻ¼ŪøıäµÄĀČŌŖĖŲµÄÖŹĮæĪŖ106.5g£®
µćĘĄ ±¾Ģāæ¼²éŃõ»Æ»¹Ō·“Ó¦µÄ¼ĘĖć£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕŃĪĖįµÄ×÷ÓĆ”¢ĪļÖŹµÄĮæµÄĻą¹Ų¼ĘĖćĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓė¼ĘĖćÄÜĮ¦µÄ漲飬עŅāHClÖ»ÓŠŅ»°ė×÷»¹Ō¼Į£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 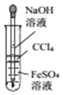 ÓĆĖłŹ¾×°ÖĆÖĘČ”²¢¹Ū²ģFe£ØOH£©2 | |
| B£® | 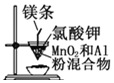 ÓĆĖłŹ¾×°ÖĆÖĘČ”½šŹōĆĢ | |
| C£® | 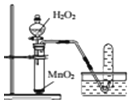 ÓĆĖłŹ¾×°ÖĆÖĘČ”øÉŌļµÄO2 | |
| D£® | 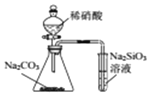 ÓĆĖłŹ¾×°ÖĆ±Č½ĻN”¢C”¢SiµÄ·Ē½šŹōŠŌĒæČõ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µćČ¼µÄ¾Ę¾«µĘ²»Š”ŠÄ“ņĖéĮĖ£¬æÉÖ±½ÓÓĆ×ŌĄ“Ė®Ćš»š | |
| B£® | µćČ¼ĒāĘųĒ°ĻČŃé“æ | |
| C£® | Õō·¢Ź³ŃĪČÜŅŗŹ±£¬·¢ÉśŅŗµĪ·É½¦ĻÖĻó£¬Ó¦Į¢¼“¼ÓĖ®ĄäČ“ | |
| D£® | ŌŚŹµŃéŹŅæÉŅŌÓĆæŚ³¢Ą“¼ų±š»ÆѧŅ©Ę· |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Č¼Ćŗ·ĻĘųÖŠµÄµŖŃõ»ÆĪļ£ØNOx£©”¢¶žŃõ»ÆĢ¼µČĘųĢ壬³£ÓĆĻĀĮŠ·½·Ø“¦Ąķ£¬ŅŌŹµĻÖ½ŚÄܼõÅÅ”¢·ĻĪļĄūÓĆµČ£®
Č¼Ćŗ·ĻĘųÖŠµÄµŖŃõ»ÆĪļ£ØNOx£©”¢¶žŃõ»ÆĢ¼µČĘųĢ壬³£ÓĆĻĀĮŠ·½·Ø“¦Ąķ£¬ŅŌŹµĻÖ½ŚÄܼõÅÅ”¢·ĻĪļĄūÓĆµČ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | »·¾³ŅŖĒó | Ąė×Ó»ņ·Ö×Ó |
| A | Al2£ØSO4£©3ČÜŅŗÖŠ | K+£¬AlO${\;}_{2}^{-}$£¬Cl-£¬NO${\;}_{3}^{-}$ |
| B | µĪ¼ÓŹÆČļŹŌŅŗĻŌĄ¶É«µÄČÜŅŗÖŠ | Na+£¬K-£¬SO${\;}_{3}^{2-}$£¬S2- |
| C | Ė®µēĄė²śÉśµÄc£ØOH-£©=10-12mol•L-1µÄČÜŅŗ | ClO-£¬CO${\;}_{3}^{2-}$£¬NH${\;}_{4}^{+}$£¬K- |
| D | ĀČĘųÖŠ | O2£¬NH3£¬CO2£¬HCl |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
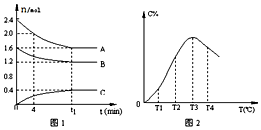
| A£® | t1Ź±æĢĒ°£¬»ģŗĻĘųĢåµÄĆÜ¶Č¼õŠ”£¬t1Ź±æĢŗ󣬻ģŗĻĘųĢåµÄĆÜ¶Č²»±ä | |
| B£® | øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½K=$\frac{c£ØC£©}{{c}^{2}£ØA£©•c£ØB£©}$ | |
| C£® | ÓÉT1ĻņT2±ä»ÆŹ±£¬VÕż£¾VÄę | |
| D£® | “Ė·“Ó¦µÄÕż·“Ó¦ĪŖ·ÅČČ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | ŹµŃé | ĻÖĻó | ½įĀŪ |
| A | ³£ĪĀĻĀ½«Cu·ÅČėÅØH2SO4ÖŠ | Éś³É“Ģ¼¤ŠŌĘųĪ¶ĘųĢå | CuÓėÅØH2SO4·“Ӧɜ³ÉSO2 |
| B | ĻņijČÜŅŗÖŠ¼ÓČėCCl4£¬Õńµ“ŗó¾²ÖĆ | ŅŗĢå·Ö²ć£¬ĻĀ²ć³Ź×ĻŗģÉ« | øĆČÜŅŗÖŠ“ęŌŚI- |
| C | Ļņ1.0mol•L-1µÄNaHCO3ČÜŅŗÖŠµĪ¼Ó2µĪ¼×»ł³Č | ČÜŅŗ³Ź»ĘÉ« | NaHCO3ČÜŅŗ³Ź¼īŠŌ |
| D | ĻņÅØ¶Č¾łĪŖ0.1mol•L-1µÄAl2£ØSO4£©3”¢Fe2£ØSO4£©3µÄČÜŅŗÖŠÖšµĪ¼ÓČė°±Ė® | ĻČÓŠŗģŗÖÉ«³ĮµķÉś³É£¬ŗóÓŠ°×É«³ĮµķÉś³É | Al£ØOH£©3 µÄČܶȻż±ČFe£ØOH£©3µÄ“ó |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com