
【题目】为了除去SO2中少量的HCl气体,应将混合气体通入( )
A.溴水B.NaHSO3饱和溶液
C.NaOH溶液D.NaHCO3饱和溶液
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在通常条件下能一步转化的组合只有
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①②③ B. ①③④ C. ②③ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分 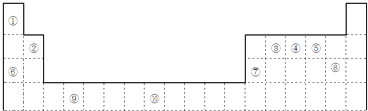
(1)元素⑩的次外层电子数为个.
(2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是;
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的离子方程式;
(4)根据下列五种元素的第一至第四电离能数据(单位:kJmol﹣1),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一主族的是 . (填元素代号)
②T元素最可能是(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法错误的是( )
硫酸化学纯(CP)
(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84g/cm3
质量分数:98%
A. 该硫酸试剂的物质的量浓度为18.4mol·L-1
B. 该硫酸与等体积的水混合所得溶液的质量分数大于49%
C. 配制200mL 4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D. 常温下,将2.7gAl投入足量该硫酸中可得到标准状况下的氢气3.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
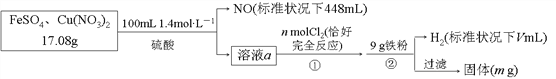
下列叙述中不正确的是( )
A. n=0.02 B. m=3.2
C. V=2240 D. 原混合物中FeSO4的质量分数约为89%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硝酸和浓硫酸的叙述中正确的是
A.常温下都不可用铝制容器贮存
B.露置在空气中,容器内酸液的质量都减轻
C.常温下都能与铜较快反应
D.露置在空气中,容器内酸液的浓度都降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是( )
A.硫在空气中燃烧
B.铜片与浓硫酸共热
C.红热的木炭与浓硫酸反应
D.亚硫酸钠与较大浓度硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下面实验装置设计实验制备SO2并进行相关探究活动。
已知:酸性强弱:H2SO3>H2CO3>HClO
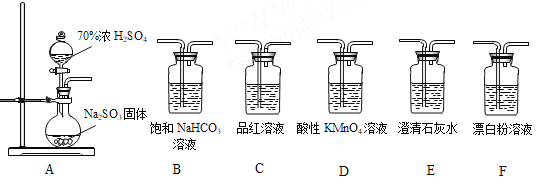
(1)装置A中反应的化学方程式为________________________________________。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→( )→( ) →C→F。________
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是________________________,通过_______________________现象即可证明亚硫酸酸性强于碳酸。
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_______________。
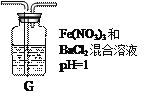
推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO![]() 氧化;
氧化;
原因二:SO2被Fe3+氧化;
原因三:________________________。
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为空气的成分。F的焰色反应是黄色。在G中,金属元素与非金属元素的原子个数比为2:1。在一定条件下,各物质之间的相互转化关系如图(反应条件及部分产物未列出):
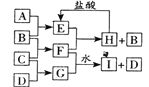
(1)A的元素符号是______________,F的电子式为________________________。
(2)E与F反应的化学方程式:_________________________________________。
(3)F与G的水溶液反应的离子方程式:______________________________。
(4)硫与热浓氢氧化钠溶液反应的离子方程式:__________________________。
(5)在加热条件下浓硝酸可把硫单质氧化到最高价产物,写出反应的化学方程式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com