
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为__;常温下丁溶液pH___7(填“>”“<”或“=”),用离子方程式解释原因____________;
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。回答下列问题:
①A在周期表中位置为___________;
②向丁的水溶液中滴入紫色石蕊试液,现象为_____________________;
③写出加热条件下上述生成丙的化学方程式__________________;
④向MCl2的溶液中通入丁,生成白色MCl沉淀,写出该反应的离子方程式__________;
⑤已知常温下弱电解质的电离平衡常数如下:一水合氨Kb=1.8×10-5,戊:Ka1=1.3×10-2, Ka2 = 6.3×10 -8。若一水合氨与丁恰好完全反应生成正盐,则浓度为0.1 mol/L的该正盐溶液呈____性(填“酸”或“碱”或“中”);调整二者反应的比值可使溶液呈中性,此时溶液中![]() ____2(填“>”“<”或“=”)。
____2(填“>”“<”或“=”)。
【答案】![]() >CO32-+H2O
>CO32-+H2O![]() HCO3-+OH-第二周期ⅥA族紫色石蕊变成红色且不褪色2Cu2O+Cu2S=6Cu+SO2↑(条件:加热)2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+碱>
HCO3-+OH-第二周期ⅥA族紫色石蕊变成红色且不褪色2Cu2O+Cu2S=6Cu+SO2↑(条件:加热)2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+碱>
【解析】
(1)根据甲为淡黄色固体且是两种元素(A和M)组成的化合物,可推知是Na2O2,其电子式为![]() ,而且乙(B和M组成)和丙(只含有M)均为常温下的无色无味气体,则丙是单质,则根据反应:甲+乙=丙+丁,可推出乙为CO2、丙为O2、丁为Na2CO3; Na2CO3水解CO32-+ H2O
,而且乙(B和M组成)和丙(只含有M)均为常温下的无色无味气体,则丙是单质,则根据反应:甲+乙=丙+丁,可推出乙为CO2、丙为O2、丁为Na2CO3; Na2CO3水解CO32-+ H2O![]() HCO3-+ OH-使溶液显碱性,故pH>7。故答案为:
HCO3-+ OH-使溶液显碱性,故pH>7。故答案为:![]() ;>;CO32-+H2O
;>;CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(2)根据题意知丁为SO2,丙为Cu,即A、B、M是S、O、Cu中的一种,该反应是火法炼铜:2Cu2O + Cu2S = SO2+ 6Cu,根据M均显+1价知M是Cu,再根据原子序数B大于A知A为O、B为S;①O在周期表的第二周期VIA族②二氧化硫与氯化铁溶液发生氧化还原反应,现象是氯化铁溶液由黄色变为浅绿色④氯化铜与二氧化硫也可发生氧化还原反应生成CuCl沉淀,2Cu2++ SO2+ 2Cl-+ 2H2O = 2CuCl↓ + SO42-+ 4H+⑤由题给信息可得一水合氨的电离平衡常数大于H2SO3的第二级电离平衡常数,则NH4+水解程度小于SO32-,故溶液显碱性;调整二者反应的比值可使溶液呈中性,此时溶液中电荷守恒的表达式为:C(H+)+ C(NH4+)= C(HSO3-)+2C(SO32-)+C(OH-),因C(H+)=C(OH-),所以有C(NH4+)= C(HSO3-)+2C(SO32-),![]() >2,故答案为:碱、>。
>2,故答案为:碱、>。


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】关于工业生产的叙述,错误的是 ( )。
A.制普通玻璃的主要原料是纯碱、石灰石、石英
B.氨是制作氮肥、硝酸、铵盐的重要原料
C.将二氧化硫催化氧化生成三氧化硫后,在吸收塔内用水吸收制得浓硫酸
D.制造普通水泥的主要原料是黏土、石灰石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 加水稀释0.01 mol·L-1的CH3COOH溶液,溶液中c(OH-)减小
B. 室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
C. 氨水加水稀释后,溶液中![]() 的值增大
的值增大
D. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法不正确的是
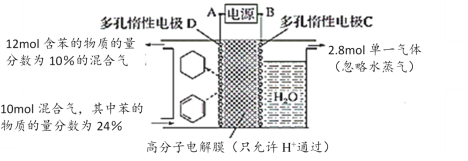
A. 电源A为负极,电极C为阳极
B. 单一气体为O2
C. 该储氢装置的电流效率约为32.1%(电流效率计算公式为=![]() ×100%)
×100%)
D. 电子流动方向为:A→D;C→B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通锌锰电池(俗称干电池)构造如图所示。

(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH
①正极发生的主要反应是____________;
②普通锌锰电池即使不使用,也易发生电解质的泄漏,结合电池结构及相关知识,用适当的化学用语及文字解释原因___________;
(2)下左图表示回收利用废旧普通锌锰电池的工艺(不考虑废旧电池中存在的少量其他金属)。

①滤液加入稀盐酸反应的化学方程式为____________,冷却得到化合物B的化学方程式为____________;
②操作a中得到熔块的主要成分是K2MnO4,在操作a中,KClO3的作用是______;
③操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为____________;黑褐色固体可循环使用,检验其是否洗涤干净的实验方案是___________;
④采用惰性电极电解K2MnO4溶液也能得到化合物D,写出其对应的电极反应_______。
⑤往化合物A的溶液中加入足量的氢氧化钠溶液。溶液中离子浓度随pH变化如图所示,回答下列问题:

i M(OH)2属于____________氢氧化物(填“酸性”、“碱性”、“两性”或“中性”);
ii从图中数据可得M(OH)2的Ksp=____________;
iii往2L 1.00mol·L-1 A溶液中加入NaOH固体至pH=6.00,需NaOH=___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
A. 所得溶液中的c(H+)=1.0×10-13mol·L-1
B. 所得溶液中由水电离产生的c(OH-)=1.0×10-13mol·L-1
C. 所加的烧碱溶液pH=13
D. 所得溶液中的c(Mg2+)=5.6×10-10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。N在元素周期表中的位置:____________。元素C、N最简单气态氢化物中稳定性更强的是_______(填化学式)。
氨气应用于侯德榜制碱工艺,原理如下图所示:

(1)过程i通入NH3和CO2的顺序是___________。
(2)过程ii有利于析出更多NH4Cl(s)的原因是_____________。
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)_________________。 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com