
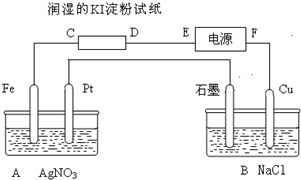
 有电解装置如图所示.图中A装置盛1L 2mol/L AgNO3溶液.通电后,润湿的淀粉KI试纸的C端变蓝色,电解一段时间后试回答:
有电解装置如图所示.图中A装置盛1L 2mol/L AgNO3溶液.通电后,润湿的淀粉KI试纸的C端变蓝色,电解一段时间后试回答:分析 通电一段时间后,发现湿润的淀粉KI试纸的C端变为蓝色,则C端发生2I--2e-=I2,则C端为阳极,D为阴极,即E为电源的负极,F为电源的正极,A池中Fe为阴极,阴极上银离子得电子生成Ag,Pt为阳极阳极上氢氧根离子失电子生成氧气,B池中Cu为阳极,Cu失电子生成铜离子,石墨为阴极,阴极上氢离子得电子生成氢气,结合电子守恒来解答.
解答 解:通电一段时间后,发现湿润的淀粉KI试纸的C端变为蓝色,则C端发生2I--2e-=I2,则C端为阳极,D为阴极,即E为电源的负极,F为电源的正极,
①E为电源的负极,故答案为:负极;
②A中Fe连接电源的负极,则为电解池的阴极,发生还原反应,为电解池的阴极,电极方程式为Ag++e-=Ag,Pt为阳极阳极上氢氧根离子失电子生成氧气,则电解总方程式为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
故答案为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
③B池中Cu为阳极,Cu失电子生成铜离子,则铜电极逐渐变细,溶液中有铜离子生成显蓝色,石墨为阴极,阴极上氢离子得电子生成氢气,即阴极上有气泡生成,故答案为:Cu电极变细,溶液显蓝色,石墨电极处产生气泡;
④B中:Cu极上的电极反应:Cu-2e-=Cu2+,石墨上发生的电极反应:2H++2e-=H2↑,
总的电池反应为(NaCl作电解质):Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cu(OH)2;
所以A中发生反应的化学方程式为:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag↓+O2↑+4HNO3;
电解一段时间,A、B装置共收集到0.168 L气体(标准状况),该气体的物质的量为7.5×10-3mol,且是H2、O2的混合气体,由于是串联电路,故流过线路上的电子的物质的量相同,所以氢气和氧气的物质的量之比为2:1,即H2为5.0×10-3mol,O2为2.5×10-3mol.
根据关系式:
O2↑~4HNO3
1 mol 4 mol
2.5×10-3mol 1.0×10-2 mol
所以A装置在t时,c(HNO3)=1.0×10-2mol•L-1,即氢离子浓度为0.01mol/L,则溶液的pH为2;
故答案为:2.
点评 本题考查学生有关电解池的工作原理知识,注意把握阴阳两极上离子的放电顺序,明确电极反应式中电子与各物质之间的关系是解题的关键,题目难度中等.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
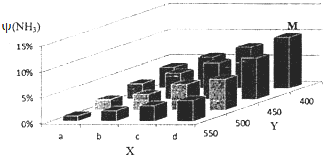 合成氨的工业化生产,解决了世界粮食问题,是重大的化学研究成果.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用N2(g)+3H2(g)?2NH3(g)△H<0反应模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
合成氨的工业化生产,解决了世界粮食问题,是重大的化学研究成果.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用N2(g)+3H2(g)?2NH3(g)△H<0反应模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2C2O4溶液:c(OH-)═c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)═2c(CO32-)+c(OH-) | |
| D. | CH3COONa和CaCl2溶液:c(Na+)+c(Ca2+)═c(CH3COO-)+c(OH-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
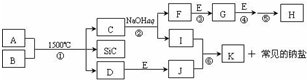 如图是一些常见元素的单质或化合物之间的转化关系.溶液中的水以及部分反应物或生成物未标出.A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,并且C的原子数、最外层电子数之和与SiC相同,J是一种能引起温室效应的气体,K是两性化合物.反应③、④、⑤用于工业中生产H.
如图是一些常见元素的单质或化合物之间的转化关系.溶液中的水以及部分反应物或生成物未标出.A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,并且C的原子数、最外层电子数之和与SiC相同,J是一种能引起温室效应的气体,K是两性化合物.反应③、④、⑤用于工业中生产H.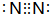 ,G的化学式NO;
,G的化学式NO;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜片表面发生氧化反应 | B. | 电子从铜片流向锌片 | ||
| C. | 电流从锌片流向铜片 | D. | 锌片为负极铜片为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
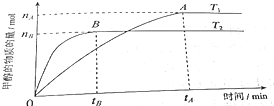
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的表面都电镀上一层耐腐蚀的黄金 | |
| B. | 环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去 | |
| C. | 铜的金属活动性比氢小,因此不易被氧化 | |
| D. | 它们是含一定比例金、银、锡、锌的铜合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
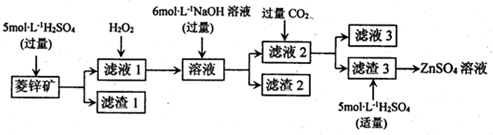
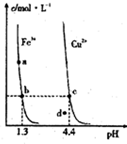 ②常温下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH.金属阳离子浓度的变化如图所示,下列判断正确的是BC.
②常温下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH.金属阳离子浓度的变化如图所示,下列判断正确的是BC.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com