
| A. | ①②③④ | B. | ④⑤⑥ | C. | ②③⑥ | D. | ①③⑤ |
分析 活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,据此分析分析解答.
解答 解:①Na2O2中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,故不选;
②CH2Cl2中只存在C-H、C-Cl原子之间的极性键,不存在非极性键,故选;
③HCN的结构式为H-C≡N,不存在非极性键,只存在极性键,故选;
④CH2═CH2中C-H原子之间存在极性键、C-C原子之间存在非极性键,故不选;
⑤CH3COOH中C-H、C-O、O-H原子之间存在极性键,C-C原子之间存在非极性键,故不选;
⑥NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,故选;
故选C.
点评 本题考查化学键判断,为高频考点,侧重考查学生分析判断能力,明确极性键和非极性键区别是解本题关键,知道常见有机物结构特点,题目难度不大.


科目:高中化学 来源: 题型:解答题
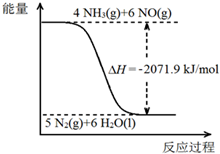 尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.尿素在一定条件下可将氮的氧化物还原为氮气.
尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.尿素在一定条件下可将氮的氧化物还原为氮气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 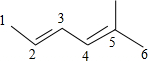 :5-甲基-2,4-己二烯 :5-甲基-2,4-己二烯 | B. |  1,2,3,4-四甲基环己烷 1,2,3,4-四甲基环己烷 | ||
| C. |  :1,3,4-三甲基苯 :1,3,4-三甲基苯 | D. | 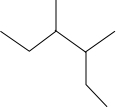 :3-甲基-2-乙基戊烷 :3-甲基-2-乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中硅元素均以SiO2形式存在 | |
| B. | 高纯度晶体Si可用于制造光导纤维 | |
| C. | 该反应条件下C的还原性比Si强 | |
| D. | 生成4.48LCO时转移电子数为0.4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 投料比 CO的体积分数% 温度/℃ | $\frac{n({H}_{2}O)}{n(CO)}$=1 | $\frac{n({H}_{2}O)}{n(CO)}$=3 | $\frac{n({H}_{2}O)}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 | |
| B. | 二氧化硫、氮氧化物和可入肺颗粒物是雾霾的主要成分,PM2.5就是指大气中直径小于或等于2.5微米的可入肺颗粒物 | |
| C. | 屠呦呦最早提出用乙醚提取青蒿,其提取物抗疟作用达95%到100%,这种提取原理就是蒸馏,属于物理过程 | |
| D. | 不锈钢具有较强的抗腐蚀性,是因为在钢铁表面镀上了金属铬 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com